
题目列表(包括答案和解析)
28.(16分)香豆素内酯化学式为C9H6O2,其分子结构中除含有一个苯外,还有六元环,它可以通过下列合成路线得到:
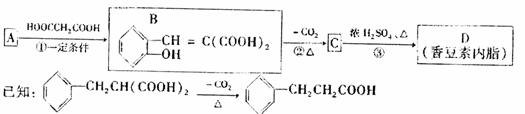
请回答下列问题:
(1)化合物B含有的官能团有(写名称):羟基、 。
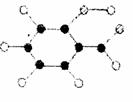 (2)A的分子结构模型如右图所示(图中球与球之间的连线代
(2)A的分子结构模型如右图所示(图中球与球之间的连线代
表化学键,如单键、双键)。则A的结构简式为 。
(3)反应③的化学方程式为 。
(4)写出C物质与足量NaOH溶液反应的化学方程式 。
(5)A的同分异构体有多种,其中含苯环的同分异构体有(可
以不填满,也可增加)
(6)现有C和D的混合物n mol,在空气中完全燃烧,生成CO2
a L、H2O b g。若设C、D混合物中C的物质的量为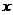 ,则
,则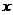 的计算式为(用题中所给字母表示) 。
的计算式为(用题中所给字母表示) 。
27.(12分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂其生产工艺如下:
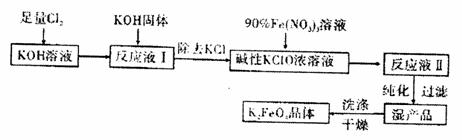
已知:①2KOH+Cl2 KCl+KClO+H2O(条件:温度较低)
②6 KOH+3 Cl2 5KCl+KClO3+3H2O(条件:温度较高)
 ③Fe(NO3)3 +KClO+KOH
K2FeO4+KNO3+KCl+H2O
③Fe(NO3)3 +KClO+KOH
K2FeO4+KNO3+KCl+H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行。(2)配平得到“反应液Ⅱ”的化学反应方程式:
 □Fe(NO3)3 +□KClO+□KOH
□K2FeO4+□KNO3+□KCl+□H2O
□Fe(NO3)3 +□KClO+□KOH
□K2FeO4+□KNO3+□KCl+□H2O
(3)在“反应液Ⅰ”中加KOH固体的主要目的是 。
A.与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为KClO
(4)若从“反应液Ⅱ”中分离出m g K2FeO4,则理论上至少消耗氯气V L(换算为标准
状况)。
V= L(用含字母m的算式表示)。
(5)将适量K2FeO4晶体分别溶解于pH为4.74、7.00、11.50的水溶液中,配制FeO42-
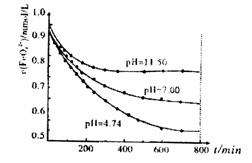 浓度均为1.0×10-3mol·L-1的试样,分别静 置800min至FeO42-浓度不再改变,结
浓度均为1.0×10-3mol·L-1的试样,分别静 置800min至FeO42-浓度不再改变,结
果见右图。已知高铁酸钾在水中的反应为:
 FeO42-+10 H2O 4 Fe(OH)3+8OH
FeO42-+10 H2O 4 Fe(OH)3+8OH
+3O2↑。发现初始pH=11.50的溶液中, 800min时高铁酸钾的最终浓度比pH=4.74的溶液中高,主要原因是: 。
26.(16分)某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜。制备方法如下:
方法一:
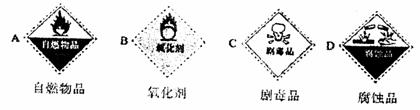
(1)浓硫酸试剂瓶上适合贴上的标签是 (填序号)。
(2)甲同学取6.4 g铜片和10 mL 18mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中白色沉淀的主要成分。设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象: ;
实验结论:所得白色固体的化学式为 。
(3)乙还观察到加热过程中,起初液面以下出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸面消失。淡黄色固体消失的原因是(用化学反应方程式回答) 。直到最后反应完毕,发现试管中还有铜片剩余。乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是 。
|
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 2CuO,CuO+H2SO4=Cu SO4+H2O。对比甲的方案,你认为丙同学的优点是
① ,② 。
方法三:
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色。写出反应的化学反应方程式 。
25.(14分)已知:X、Y、Z、W为短期元素,Q为人体血红蛋白中所必需的金属元素。X 原子最外层电子排布为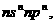 Y原子的L层s电子数比p电子数少1。在第三周期主族元素中,Z元素第一电离能最大;W元素原子半径最大。请回答:
Y原子的L层s电子数比p电子数少1。在第三周期主族元素中,Z元素第一电离能最大;W元素原子半径最大。请回答:
(1)X位于元素周期表中第 周期 族。
Q元素原子基态时的核外电子排布式为 。
(2)X、Y元素对应的氢化物中键能X-H键 Y-H键(填“<”、“>”=
(3)QZ3溶液呈酸性,用离子方程式表示其产生酸性的原因 。
(4)WY3是抗禽流感药物“达菲”合成过程中的中间活性物质,WY3也可用于汽车的保护气囊。3 mol WY3受撞击会生成4 mol Y2气体和一种离子化合物A。
①请写出上述WY3撞击反应的化学方程式 。
②根据电子云的重叠方式判断:Y2分子中存在的σ键和π键数目之比为 : 。
13.25℃,将Va mL pH=2的CH3COOH溶液与Vb mL pH=12的NaOH溶液混合。下列说法正确的是 ( )
A.若Va=Vb,则混合后溶液pH=7
B.若Va<Vb,则混合后溶液pH一定大于7
C.若Va=Vb,则CH3COOH与NaOH恰好完全中和
D.若Va=Vb,混合后溶液中微粒浓度的关系可能为:
 c(CH3COO)>c(Na+)>c(H+)>c(OH-)
c(CH3COO)>c(Na+)>c(H+)>c(OH-)
第Ⅱ卷(本卷共11小题,共180分)
12.下列反应离子方程式正确的是 ( )
A.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4 Fe3++2H2O
C.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O
D. H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42- BaSO4↓+H2O
0.04 mol·(L·min)-1
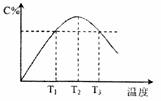
B.图中T1时正反应速率等于温度T3时正反应速率
C.该反应温度T2时的平衡常数大于温度T3的平衡常数
D.图中T2时,若只增大压强,刚正、逆反应速率不改变
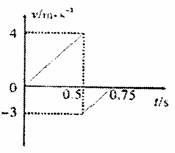
11. 某温度下,在体积为2L的密闭容器中充入1 mol A和a mol B气体,发生如下反乏应: A(g)+B(g) 2C(g)5 rnin后反应达到平衡时n(A)为0.4 moll。在反应过程
某温度下,在体积为2L的密闭容器中充入1 mol A和a mol B气体,发生如下反乏应: A(g)+B(g) 2C(g)5 rnin后反应达到平衡时n(A)为0.4 moll。在反应过程
中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如右图所示。下列叙述正确的是( )
 A.0-5 min,C物质的平均反应速率为
A.0-5 min,C物质的平均反应速率为
10.意大利罗马大学的FulvioCacace等获得了极其理论研究意义的气态N4分子,其分子结 构如右图所示。已知断裂1 mol N-N吸收167 kJ热量、生成1 mol N=N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )
 A.N4与N2互为同位素
A.N4与N2互为同位素
B.N4分子较N2分子稳定
C.N4分子中共价键数和共用电子对数之比为2:3
D.将l mol N4转变成N2释放882 kJ热量
7.“碳捕捉和储存(CCS)”技术是指通过碳捕捉技术,将工业和有关能源产业所产生的二氧化碳分离出来再利用。当前,二氧化碳及其产品的开发、应用是很多科学家致力研究的课题。下列有关说法不正确的是( )
A.人类应将大气中的二氧化碳全部捕捉,以防产生温室效应
B.对捕捉到的二氧化碳进行净化,然后用于制造干冰
C.以捕捉到的二氧化碳为原料,用来制备甲醇等产品
D.用捕捉到的二氧化碳与海藻发生光合作用,可提高海藻产量
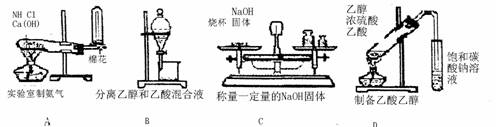 8.下图所示实验操作或装置不能达到实验目的的是 ( )
8.下图所示实验操作或装置不能达到实验目的的是 ( )
A B C D
|
阳极制得过氧化氢。电解总方程式为3H2O+3O2 3H2O+O3,下列说法正确的是( )
A.电解产物在应用中都只能作为氧化剂 B.电解一段时间后,溶液pH不变
C.阳极的反应:3H2O-6 e-=O3+6H+ D.每生成1 mol O3转移电子数为3 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com