
题目列表(包括答案和解析)
28. (14 分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(l)已知在常温常压下反应的热化学方程式:
① CO ( g ) + 2H2(g) CH3OH ( g ) △H1 = -90 kJ · mol-1
CH3OH ( g ) △H1 = -90 kJ · mol-1
② CO ( g ) + H2O ( g ) = CO2 ( g ) + H2 ( g ) △H2= -41 kJ · mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:
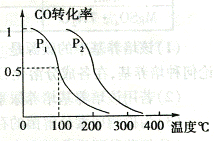 (2)在压强为0.1MPa 条件下.容积为VL 的容器中充入a mol CO 与2a mo1H2
在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示;
① P1
P2 (填大于、小于或等于);
(2)在压强为0.1MPa 条件下.容积为VL 的容器中充入a mol CO 与2a mo1H2
在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示;
① P1
P2 (填大于、小于或等于);
② 在其它条件不变的情况下,再增加a mol CO 与2a mo1H2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下同),平衡常数 。
(3)以甲醇为燃料的新型燃料电池,正极通入O2 ,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH + H2O-6e- = CO2 + 6H+ ① 正极的电极反应式是 ;放电时,H+移向电池的 (填“正”或“负”)极;
② 若以该燃料电池作为电源,用石墨作电极电解500mL 饱和食盐水,当两极共收集到标准状况下的气体1.12 L(以不考虑气体的溶解)时,所得溶液的pH = (假设反应前后溶液体积不变)。 29. (12 分)有两条途径可以使重晶石(BaSO4)转化为碳酸钡,如下图所示:
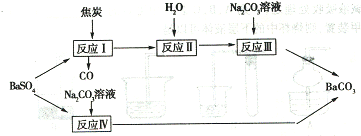
试回答下列问题: (l)反应I 中发生的主要反应为:BaSO4 + 4C = BaS + 4CO ,若1 mol BaSO4 完全反应,电子转移的物质的量为 ;
(2)Na2CO3
溶液的pH 大于10 ,用离子方程式说明其主要原因
,其溶液中离子浓度由大到小的顺序是
;
(3)已知反应IV 中发生的反应为:BaSO4 ( s ) + CO3
2-  BaCO3
( s ) + SO42- ,写出此反应平衡常数表达式K =
;若KSP (BaSO4)为
BaCO3
( s ) + SO42- ,写出此反应平衡常数表达式K =
;若KSP (BaSO4)为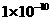
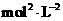 ,KSP (BaCO3)为
,KSP (BaCO3)为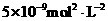 ,则K 的值为
;
(4)若每次加入1L 2mol · L-1的Na2CO3溶液,至少需要 次可以将0.2mol
BaSO4转化为BaCO3
。
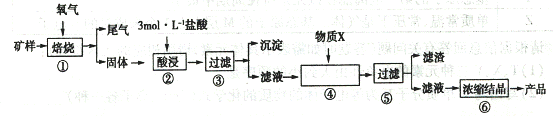
30 . (16 分)某矿样含有大量的CuS 、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuC12
· 2H2O 晶体。
,则K 的值为
;
(4)若每次加入1L 2mol · L-1的Na2CO3溶液,至少需要 次可以将0.2mol
BaSO4转化为BaCO3
。
30 . (16 分)某矿样含有大量的CuS 、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuC12
· 2H2O 晶体。
 已知:在20 ℃ 时,氯化铜的溶解度是73g ;常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
已知:在20 ℃ 时,氯化铜的溶解度是73g ;常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。

 回答下列间题:
(l)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质、右图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式
、
;
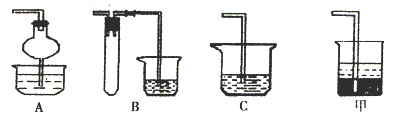
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。若在实验室中以碱液吸收处理之,下列A、B、C 装置中可行的是 (填字母);若选用甲装置,则烧杯中的下层液体可以是
;
回答下列间题:
(l)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质、右图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式
、
;
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。若在实验室中以碱液吸收处理之,下列A、B、C 装置中可行的是 (填字母);若选用甲装置,则烧杯中的下层液体可以是
;
(3)步骤② 酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时.除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有 ; (4)步骤④ 加入物质X 的目的是 ,物质X 可以选用下列物质中的 ;
A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行 次过滤操作。
[选作部分]
12.下列关于有机物的说法中,不正确的是
A.棉花、蚕丝和锦纶的主要成分都是纤维素
B.苯、乙醇和乙酸都能发生取代反应
C.将铜片在酒精灯上加热变黑后迅速插入乙醇溶液中,铜片恢复红色且质量不变
D.用新制的Cu ( OH )2可用于检验尿液中的葡萄糖
13.下列叙述正确的是
A.向次氯酸钠溶液中通入足量SO2气体的离子方程式: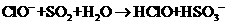
B.向明矾溶液中加入过量NaOH 溶液会产生大量白色沉淀 C.铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2 : 3
D.浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳
14. 25 ℃ 时,水的电离达到平衡: △H > 0,下列叙述正确的是
△H > 0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,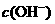 降低
B.向水中加入少量稀硫酸,
降低
B.向水中加入少量稀硫酸,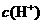 增大,Kw不变
C.向水中加入少量固体CH3COONa
,平衡逆向移动,
增大,Kw不变
C.向水中加入少量固体CH3COONa
,平衡逆向移动,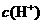 降低
降低
 D. 将水加热,Kw增大,pH不变
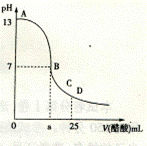
15. 25 ℃ 时,在25 mL
0.1 mol · L-1的NaOH 溶液中,逐滴加入0.2 mol · L-1的CH3COOH 溶液,溶液的pH 与醋酸溶液体积关系如图。下列分析正确的是
A. B 点的横坐标a=12.5
B. C 点时溶液中有:c(Na+)>c(CH3COO-)> c(H+)> c(OH-)
D. 将水加热,Kw增大,pH不变
15. 25 ℃ 时,在25 mL
0.1 mol · L-1的NaOH 溶液中,逐滴加入0.2 mol · L-1的CH3COOH 溶液,溶液的pH 与醋酸溶液体积关系如图。下列分析正确的是
A. B 点的横坐标a=12.5
B. C 点时溶液中有:c(Na+)>c(CH3COO-)> c(H+)> c(OH-)
C. D 点时溶液中有:2c(Na+)=c(CH3COO-)+ c(CH3COOH)
D.曲线上A 、B 间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)> c(OH-)>c(H+)
第II卷
[必做部分]
11.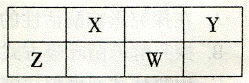 右表是元素周期表的一部分。X、Y、Z、W 均为短周期元素,X、W 的质子数之和为23 。下列说法正确的是
A.原子半径:W < Y
B.氢化物的稳定性:Y < X
C.最高价氧化物对应水化物的酸性:W > Z
右表是元素周期表的一部分。X、Y、Z、W 均为短周期元素,X、W 的质子数之和为23 。下列说法正确的是
A.原子半径:W < Y
B.氢化物的稳定性:Y < X
C.最高价氧化物对应水化物的酸性:W > Z
D. Z 的氧化物不能溶于Y 的氢化物的水溶液
9.下列说法不正确的是 A.硬铝、碳素钢都是合金材料;合成纤维、光导纤维都是有机高分子化合物
B.油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 C.处理废水时可加入明矾作为混凝剂,以吸附水中的杂质 D.推广可利用太阳能、风能的城市照明系统,发展低碳经济和循环经济,有利于改善环境质量 10.下列叙述正确的是 A.液氨可用作致冷剂 B.向Fe( OH ) 3 胶体中滴入过量的NaHSO4溶液,能使胶体发生凝聚而沉淀
C.熔融状态下能够导电的化合物中一定存在离子键 D. 28g 乙烯和氮气的混合气体中含有NA个原子(戈代表阿伏加德罗常数的值)
33、(13分)
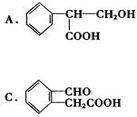
由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率。根据下面金丝桃素的结构简式回答下列问题:
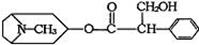
(1)金丝桃素能在NaOH水溶液中加热反应得A和B,B为芳香族化合物,写出B的结
构简式:B: ,该反应属于 反应。
(2)室温下,B用稀盐酸酸化得C,下列物质中不能和C发生反应的是 (填序号)
①浓H2SO4和HNO3的混合 ②H2(催化剂加热) ③CH3CH2CH2CH3
④Na ⑤O2(催化剂) ⑥Na2CO3溶液
(3)写出两分子C与浓H2SO4共热,生成八元环状物的化学方程式: 。
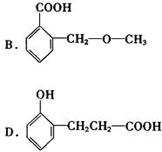 (4)下列物质与C互为同分异构体的有
。
(4)下列物质与C互为同分异构体的有
。
广东省佛山市南海石门狮山2010届高三周四测试
31.(18分)[I] 在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g) 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0-4min时,容器气体压强为0.1MPa):
|
时间min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
n(SO2) |
2.00 |
1.92 |
1.84 |
1.76 |
1.76 |
1.64 |
1.52 |
1.40 |
1.40 |
1.40 |
|
n(O2) |
1.00 |
0.96 |
0.92 |
0.88 |
0.88 |
0.82 |
0.76 |
0.70 |
0.70 |
0.70 |
|
n(SO3) |
0 |
0.08 |
0.16 |
0.24 |
0.24 |
0.36 |
0.48 |
0.60 |
0.60 |
0.60 |
 回答下列问题:
回答下列问题:
①___________________________时段,反应处于平衡状态。
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是______________________;平衡向_________________方向移动。
③在0.1MPa、500℃时,起始时O2和SO2的物质的量之比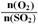 的值,与SO2平衡时的体积百分含量的变化曲线如图。
的值,与SO2平衡时的体积百分含量的变化曲线如图。
在图中画出在相同压强下,温度为400℃时,起始O2和SO2的物质的量之比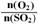 的值,与SO2平衡时的体积百分含量的大致变化曲线。
的值,与SO2平衡时的体积百分含量的大致变化曲线。
[II] (1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系不正确的是________________________
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L C.c(Na+)=c(HA)+c(A-)
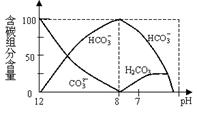 (2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的部分情况如下图所示。
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的部分情况如下图所示。
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能” 或“不能”)_______大量共存。
②已知在25℃时,CO32-水解反应的平衡常数即水解
常数Kh=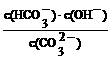 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=___________________________。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=___________________________。
31、(16分)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
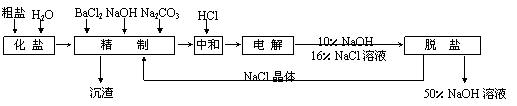
(1)精制过程中反应的离子方程式为____________________________________________
___________________________________ (任写2个)。
(2)电解过程的总反应方程式为_________________________________________。
(3)电解槽阳极产物可用于________________________________(至少写出两种用途)。
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
|
温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
|
NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐的主要工序应为_______________、_______________。脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是________
________________________________________________________________________________。
30、(17分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) 。
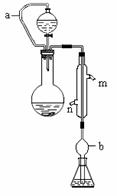 称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在强碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,实验装置如右图(图中加热及夹持仪器略去)。再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在强碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,实验装置如右图(图中加热及夹持仪器略去)。再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
|
实验次数 |
氢氧化钠溶液的体积 |
|
|
滴定前刻度(mL) |
滴定后刻度(mL) |
|
|
1 |
0.00 |
5.22 |
|
2 |
0.00 |
5.18 |
|
3 |
0.00 |
5.20 |
(1)写出圆底烧瓶内发生反应的离子方程式 ________________________________。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是_____________________________;
(3)本实验可以选择____________作为指示剂,到达滴定终点的现象为:____________________ 。
(4)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)______________。
A. 锥形瓶水洗后未烘干
 B. 滴定前俯视滴定管,滴定后平时滴定管
B. 滴定前俯视滴定管,滴定后平时滴定管
C. 滴定过程中有少量溶液从锥形瓶中溅出
D. 滴定前没有用标准液润洗滴定管
若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是_________。
(5)利用题目中所给数据计算肥料中总氮含量为_______%(计算结果保留到小数点后1位)。
23、分别在pH=1的酸溶液和pH=14的NaOH溶液中加入足量的铝粉,放出H2的量一样多,其原因可能是
A.两者溶液的体积相同,而酸是多元强酸
B.两者溶液的体积相同,酸是弱酸
C.酸是强酸,且酸溶液的浓度比NaOH溶液的浓度大
D.酸溶液的体积比NaOH溶液的体积大
22、能正确表示下列反应的离子方程式是
A.足量硫化氢气体通入硫酸铁溶液中:H2S+2Fe3+=2Fe2++S↓+2H+
B.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++2H2O+NO↑
C.醋酸溶液与纯碱反应:CO32-+2H+=H2O+CO2↑
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com