
题目列表(包括答案和解析)
1.下列表达方式正确的是( )
A.CCl4的电子式: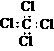 B.MgCl2的电子式:
B.MgCl2的电子式: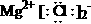
C.S2-的结构示意简图 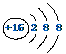 D. 中子数为20的氯原子:20Cl
D. 中子数为20的氯原子:20Cl
21.(14分)2SO2(g)+O2(g) 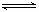 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1.请回答下列问题:
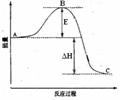
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式为
;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H= 。
20.(12分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
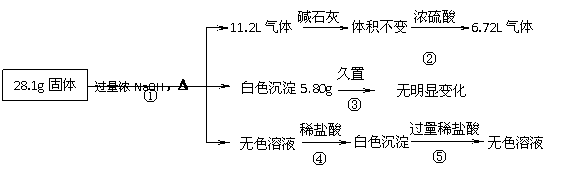
回答下列问题:
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: 。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程) 。
(5)把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3
19.(14分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2气体体积(标准状况)与所加入盐酸体积之间关系如下图所示:
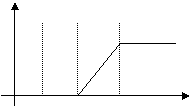 V(CO2)
V(CO2)
0 25 50 75 V(HCl)
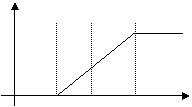 (甲)
(甲)
V(CO2)
0 25 50 75 V(HCl)
(乙)
试分析:
(1)计算NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是
甲: 其物质的量之比是
乙: 其物质的量之比是
(2)且在两种情况下产生的CO2气体体积(标准状况下)各是:
甲: mL ; 乙: mL。
(3)原NaOH溶液的物质的量浓度是
18.(8分)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量用HNO3酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为______ __________;
(2)实验④中的现象为:________ _______ ;
(3)实验②③反应的离子方程式分别是: _______________ __、__________________ ___
17.(12分)短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如下图所示转化(部分产物已略去):
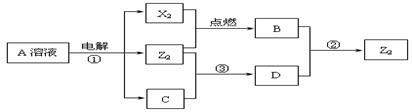
(1)Y在周期表的位置是__________________ _;Z2的结构式是________________。
(2)反应①的离子方程式是_______________________________________________。
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如下图所示(夹持固定装置的仪器已略去)。
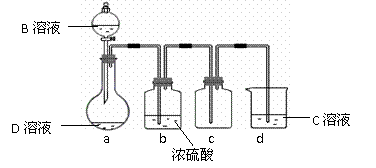
I、 写出反应②的离子方程式__________________ ___________。
II、上述实验装置不够完善,改进方法是
。
Ⅲ、足量Z2 通入FeBr2溶液中发生反应的离子方程式是 。
16.下列反应的离子方程式正确的是 ( )
A.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
B.用硫酸酸化的硫酸亚铁溶液中加入过氧化氢溶液: Fe2++2H2O2+4H+===Fe3++4H2O
C.用氨水吸收少量二氧化硫:NH3·H2O+SO2===NH4++HSO3-
D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3↓+3NH4+
第二卷(共60分)
15.常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.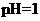 的溶液中:
的溶液中: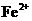 、
、 、
、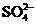 、
、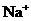
B.由水电离的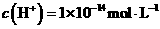 的溶液中:
的溶液中: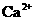 、
、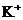 、
、 、
、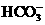
C.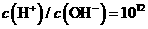 的溶液中:
的溶液中: 、
、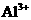 、
、 、
、
D.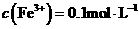 的溶液中:
的溶液中: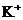 、
、 、
、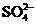 、
、
14.下列离子方程式表达正确的是 ( )
A.用惰性电极电解熔融氯化钠: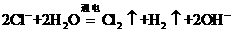
B.用氢氧化钠溶液除去铝表面的氧化膜: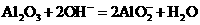
C.用稀氢氧化钠溶液吸收二氧化氮: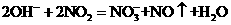
D.用食醋除去水瓶中的水垢: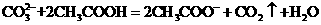
13.在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是 ( )
A.Na+、K+、MnO4-、Cl- B.Cl-、S2O32-、K+、Na+
C.Na+、Cl-、CH3COO-、K+ D.K+、I-、Na+、HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com