
题目列表(包括答案和解析)
5.设NA为阿伏加德罗常数的值,下列有关叙述中正确的是 ( )
A.标准状况下,密度为dg/L的某纯净气体一个分子的质量为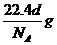
B.标准状况下,11.2LCCl4中含有的C-Cl键的数目为2NA
C.17g的氢氧根离子中含有的电子数为9NA
D.用100 mL 18.4 mol·L-1 的浓硫酸与足量的铜反应,生成SO2的分子数为0.92NA
4.下列各组离子在指定溶液中能大量共存的是 ( )
A.无色溶液中:K+、Na+、MnO4-、SO42-
B.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
C.由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
D.有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
3.下列装置能达到实验目的的是 ( )

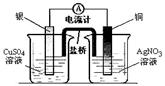

① ② ③ ④
A.实验室用装置①制取氨气
B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
2.下列有关化学用语的说法中不正确的是 ( )
A.次氯酸的结构式为:H-Cl-O
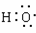
B.-OH 与 都表示羟基
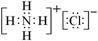
C.氯化铵的电子式:

D.乙酸的分子比例模型为:
1.世界气候大会于2009年12月在丹麦首都哥本哈根召开。会议的主题是“促进低碳经济,减少CO2的排放”。下列行为中不符合这一主题的是 ( )
A.开发新能源,如太阳能、风能等,减少对化石能源的依赖
B.限制化工发展,关停化工企业,消除污染源头
C.加快研发利用二氧化碳合成聚碳酸酯类可降解塑料
D.推广煤的气化、液化技术,提供清洁燃料和化工原料
24、(9分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示。
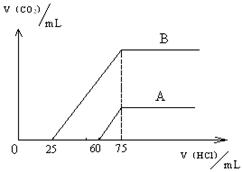
试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) __________________,其物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL(不考虑CO2的溶解,下同)。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) _____________,其物质的量之比为 ;
(3)计算原NaOH溶液的物质的量浓度(写出计算过程)。
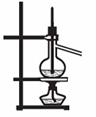
23.(10分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种,某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式,实验用到的仪器如下图所示:
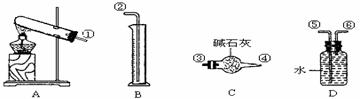
[提出猜想]
Ⅰ.所得气体的成分可能只含 一种;Ⅱ.所得气体的成分可能含有 二种;
III.所得气体的成分可能含有SO2、SO3、O2三种。
[实验探究]
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
(填序号);
(2)若实验结束,B中量筒没有收集到水,则证明猜想 正确;
(3)实验过程,仪器C的作用是 ;
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
|
实验小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算成标 准状况下气体的体积/mL |
|
① |
6.4 |
2.88 |
224 |
|
② |
6.4 |
2.56 |
448 |
请通过计算 ,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
①组 ;
②组 。
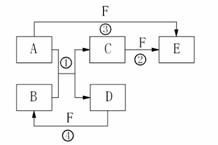
22.(8分)25.(8分)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出)。
⑴若A是常见金属单质,与B的水溶液反应生成C和D。
D、F是气体单质,D在F中燃烧时发出苍白色火焰。则反
应②(在水溶液中进行)的离子方程式为 。
⑵若A、D为短周期元素组成的固体单质,一种为金属,另一
种为非金属。且③④两个反应都有红棕色气体生成,则反应
④的化学方程式为 。
⑶若B是由地壳中含量最高的两种元素组成,A的一种同素异形体与B、D属同一种类型的晶体,则反应①的化学方程式是 ,B与烧碱溶液反应的化学方程式是 。
21.(9分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
2BrO3一+10I一+12H+=5I2+Br2+6H2O 6BrO3一+5I一+6H+=5IO3一+3Br2+3H2O
②Br2能将I一氧化为I2:Br2+2I一=2Br-+I2
③KIO3 能将I-氧化为I2,也能将Br一氧化成Br2,其本身被还原为12。
能将I-氧化为I2,也能将Br一氧化成Br2,其本身被还原为12。
IO3-+5I-十6H+=3I2+3H2O 2IO3-+10Br-+12H+=I2+5Br2+6H2O
(1)在上述反应涉及的粒字中氧化性最强的是 (填化学式,下同);
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为 ,还原产物为 ;
(3)向含有1 mol KI的硫酸溶液中加KBrO3溶液,①若反应后的碘元素只存在于I2中,溴元素只存在Br一中,则加入KBrO3的物质的量为 mol;②若反应后的碘元素只存在于I2中,溴元素只存在Br2 和Br一中,则加入KBrO3的物质的量范围为
(4)将等物质的量KBrO3溶液和KI溶液在稀H2SO4中混合。写出发生反应的离子方程式 。
20.(10分)离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ② 氧化物 ③电解质 ④盐 ⑤化合物
氧化物 ③电解质 ④盐 ⑤化合物
(2)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性。排除_________离子存在。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除 存在。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉淀产生,则可排除_________的存在。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明______存在,又排除________存在。
⑤根据上述实验事实还不能确定是否存在的离子是____ ____;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com