
题目列表(包括答案和解析)
14.将溶质A的质量分数为5X和X的两种溶液等体积混合,所得溶液中A的质量分数小于3X,则A可能是
①H2SO4 ②C2H5OH ③NH3 ④CH3COOH ⑤NaOH
A.①⑤ B.①④⑤ C.②③ D.②③④
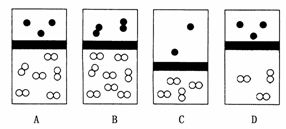
13.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是
12.下列说法正确的是
A.在标准状况下,1mol H2O和1mol H2的体积都约是22.4L
B.2gH2和44gCO2的体积相等
C.1mol某气体的体积为22.4L,则该气体一定处于标准状况
D.在标准状况下,1gH2和11.2LO2的物质的量相等
11.用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;② 1mol Na2O2与水完全反应时转移电子数为2NA ;③1molC10H22分子中共价键总数为31NA ;④在标准状况下,22.4LSO3的物质的量为1mol;⑤7.8g过氧化钠中含有的离子数为0.3NA;⑥28g 硅晶体中含有2NA个Si-Si键
A.③⑤⑥ B.①③⑤ C.②④⑥ D.③④⑤
10. 下列说法中正确的是
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g
9.为了测定某碱金属M的相对原子质量,设计了如右图所示的装置。仪器本身连同水的质量为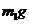 。若向瓶中投入
。若向瓶中投入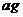 金属M,实验完毕后,测得装置的质量为
金属M,实验完毕后,测得装置的质量为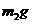 。则计算碱金属M的相对原子质量的算式和实验值与正确值的比较分别是
。则计算碱金属M的相对原子质量的算式和实验值与正确值的比较分别是
 A.
A. 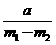 、偏小 B.
、偏小 B. 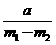 、偏大
、偏大
C.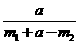 、偏大 D.
、偏大 D.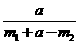 、偏小
、偏小
8. 碱金属与卤素所形成的化合物大都具有的性质是
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①②③ B.③④⑤ C.①②⑤ D.②③⑤
7. 可以判断NaHCO3 粉末中混有Na2CO3的实验方法是
A、加热时有无气体放出 B、滴加盐酸时有无气体放出
C、溶于水后滴加BaCl2有无沉淀 D、溶于水后滴加澄清的石灰水,有白色沉淀
6.下列物质混合以后,有气体生成,最终又有白色沉淀或固体的是
A.过量氢氧化钠溶液和明矾溶液 B.少量电石和过量碳酸氢钠溶液
C.过氧化钠和少量氯化亚铁溶液 D.铜片和三氯化铁溶液
5.下面是比较过氧化钠与氧化钠性质异同点的有关叙述,其中错误的是
A.过氧化钠和氧化钠都是白色固体物质
B.过氧化钠和氧化钠都能与或CO2水发生反应
C.过氧化钠和氧化钠与水反应都有NaOH生成
D.过氧化钠是强氧化剂,氧化钠只是一种碱性氧化物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com