
题目列表(包括答案和解析)
11、对于平衡体系mA(g)+nB(g)
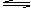 pC(g)+qD(g);ΔH<0。下列结论中正确的是( )
pC(g)+qD(g);ΔH<0。下列结论中正确的是( )
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48 倍,则
m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始A、B的物质的量之比为m∶n
C.若温度、体积不变,当m+n<p+q时,向平衡体系中再加入少量气体E(E与所有组分均不反应),A的转化率减小
D.若升高温度,则反应中逆反应速率减小,正反应速率增大
10、将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)+2M(s) 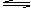 2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
|
选择 |
改变的条件 |
正、逆反应速率变化 |
新平衡和原平衡比较 |
|
A |
升高温度 |
逆反应速率增大量大于正反应速率增大量 |
X的体积分数变大 |
|
B |
增大压强 |
正反应速率增大,逆反应速率减小 |
Z的浓度不变 |
|
C |
减小压强 |
正、逆反应速率都减小 |
Y的体积分数变大 |
|
D |
充入一定量Z |
逆反应速率增大 |
X的体积分数变大 |
9、短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是( )
A.离子半径:Y>X
B.气态氢化物的稳定性:Z>X
C.Y的氧化物中含有离子键
D.Z的氧化物对应的水化物是弱碱
8、下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③沸点:H2Se>H2S>H2O
④结合H+能力:OH->CH3COO->I-
A.①③ B.②③ C.①④ D.②④
7、已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径 A>B>D>C B.原子序数 b> a >d>c
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
6、用密度为ρ1 g/cm3,质量分数是ω的浓盐酸,配制成体积比为1∶4的稀盐酸,密度为 ρ2 g/cm3,则所配制稀盐酸的物质的量浓度为( )
A.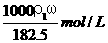 B.
B.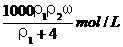
C.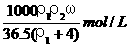 D.
D.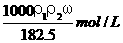
5、下列关于热化学反应的描述中正确的是( )
A.HCI和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH) 2反应的中和热△H=2×(-57.3)KJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2 (g)=2CO(g)+O2 (g)反应的
△H=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
4、 已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)
 2NH3(g);△H=-92.0KJ·mol-1,将1mol
N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol
NH3,反应达到平衡时测得NH3的转化率为α2 ,吸收热量为Q2。下列说法错误的是( )
2NH3(g);△H=-92.0KJ·mol-1,将1mol
N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol
NH3,反应达到平衡时测得NH3的转化率为α2 ,吸收热量为Q2。下列说法错误的是( )
A.Q1 + Q2 = 92.0KJ B.α1 + α2 = 1
C.Q1 + Q2 = 184.0KJ D.α1/α2 = Q1/ Q2
3、下列离子方程式中正确的是( )
A.铜与稀硝酸反应:
Cu+2H++NO3-===Cu2++NO↑+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:
Fe2++2H++H2O2===Fe3++2H2O
C.过量的二氧化碳通入漂白粉溶液中:ClO-+CO2+H2O===HClO+HCO3-
D.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO2-+2H2O+4NH4+
2、设NA为阿伏加德罗常数,下列叙述中不正确的是( )
A.46g NO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L D2中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com