
题目列表(包括答案和解析)
 有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.
有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.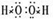



| ||
| ||
2- 4 |
2- 4 |
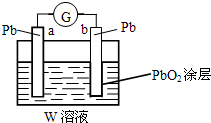
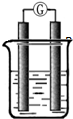 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
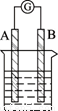
|
序号 |
A |
B |
烧杯中的液体 |
指针是否偏转 |
|
1 |
Zn |
Cu |
稀硫酸 |
有 |
|
2 |
Zn |
Zn |
稀硫酸 |
无 |
|
3 |
Cu |
C |
氯化钠溶液 |
有 |
|
4 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com