
27.Cl2氧化Br-应在 条件下进行,目的是为了避免
8.(2013·上海化学·27-30)溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
7.(2013·福建理综·24)(14分)
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________[已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9]
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
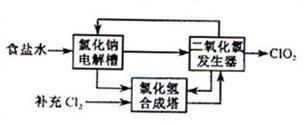 工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
[知识点]粗盐提纯,溶度积常数Ksp,化学方程式的书写,氧化还原反应类型的方程式
的配平以及相关的化学计算。
[答案]
(1)①BaCl2 BaSO4 和BaCO3 的Ksp 相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s)(或其他合理答案)
②H2、Cl2 2NaClO3+ 4HCl= 2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)1C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
(3)2.5
[解析](1)①根据提纯的流程可知,先加入的试剂是除去杂质SO42-,在不引入新的杂质的前提下,滴加的试剂是BaCl2。根据所给的Ksp:BaSO4 和BaCO3 的Ksp 相差不大,当溶液中存在大量CO32-时,会导致BaSO4(s)会部分转化为BaCO3(s),这时溶液中就出现了SO42- 。
②电解食盐水的方程式为: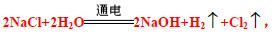 所以可以得到的单质是:H2 和Cl2。发生器中的反应物是NaClO3 和HCl,根据流程图可知生成的物质有:ClO2、Cl2 以及NaCl(根据元素守恒还有水)。所以化学方程式为2NaClO3+
4HCl= 2ClO2↑+Cl2↑+ 2NaCl + 2H2O。
所以可以得到的单质是:H2 和Cl2。发生器中的反应物是NaClO3 和HCl,根据流程图可知生成的物质有:ClO2、Cl2 以及NaCl(根据元素守恒还有水)。所以化学方程式为2NaClO3+
4HCl= 2ClO2↑+Cl2↑+ 2NaCl + 2H2O。
(2)纤维素属于多糖,水解产物是葡萄糖(C6H12O6),根据元素守恒,生成的产物还有2 4 Na2SO4。根据H原子个数守恒(36-24 =12),可知葡萄糖分子的系数是1 ,然后在满足其他原子个数守恒, 即可配平此方程式:1C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4。处理的过程发生了氧化还原反应,根据电子守恒2.5Cl2︿ClO2。
6.(2013·海南化学·14)(9分)
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)=2 CuBr(s)+ Br2(g) △H=+105.4kJ/mol
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
[答案] (1)Cl2 3 Br2+6 CO32-+3H2O=5 Br-+ BrO3-+6HCO3-
(或3 Br2+3CO32-=5 Br-+ BrO3-+3CO2)
(2)Br BrCl+H2O=HCl+ HBrO (3)①增大 ②2.33×103Pa< p(Br2)≤4.66×103Pa
[解析]:(1)溴在碳酸钠溶液的歧化可把反应理解为,溴与水发生歧化,产生H+的被碳酸钠吸收。
(2)正电性的原子或原子团结合OH形成分子,则生成HBrO。(3)①升高温度,平衡向吸热反应方向移动,因而可提高p(Br2);②体积增大一倍时,p(Br2)降为原来的一半,即2.33×103Pa,减压使平衡向气体体积数增大的方向移动,因而会大于2.33×103Pa;若反应物足量,可平衡恢复到原有的p(Br2)。
5.(2013·北京理综·28)(15分)
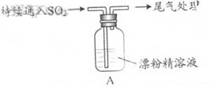
某学生对SO2与漂粉精的反应进行实验探究:
|
操作 |
现象 |
|
取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
|
过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
 |
i.
液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
 b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因:  。
。
[答案]
(1)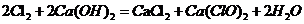 ;
;
(2)碱性、漂白性;
(3)①、检验白雾中是否Cl2,排除Cl2干扰;
②、白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①、CaSO4;
②、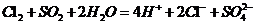 。
。
[解析]
(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水;
(2)pH试纸先变蓝(约为12),说明溶液呈碱性,后颜色褪去,说明具有漂白性;
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;
②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4;
 ②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸。
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸。
4. (2013·福建理综·6)化学与社会、生产、生活紧切相关。下列说法正确的是
A.石英只能用于生产光导纤维
B.从海水提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
[知识点]化学与生活
[答案]D
[解析]A项,二氧化硅除了用于生产光导纤维,还可用于生产石英玻璃、水泥等硅酸盐产品;B项,从海水中获取NaCl不需要化学变化(蒸发结晶);C项,食品添加剂是有意识地一般以少量添加于食品,以改善食品的外观、风味和组织结构或贮存性质的非营养物质,必须严格控制;D项,地沟油的主要成分是高级脂肪酸甘油酯,可以用于制肥皂(皂化反应)。
3.(2013·四川理综化学·1)化学与生活密切相关,下列说法不正确的是
A.二氧化硫可广泛用于食品的漂白
B.葡萄糖可用于补钙药物的合成
C.聚乙烯塑料制品可用于食品的包装
D.次氯酸钠溶液可用于环境的消毒杀菌
[答案]A
解析:SO2可被人体吸收进入血液,对全身产生毒性作用,它能破坏酶的活力,影响人体新陈代谢,对肝脏造成一定的损害,慢性毒性试验显示,SO2有全身性毒作用,故不可用于食物漂白。A错。葡萄糖酸钙常被用做补钙剂,B正确;聚乙烯可做食品的包装,而聚氯乙烯不可,C正确;“84”消毒液的有效成分就是NaClO,可用于环境消毒,D正确。
2.(2013·上海化学·16)已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A.2 4 3 2 2 6 B.0 2 1 0 1 2
C.2 0 1 2 0 2 D.2 2 2 2 1 4
[答案]B
[解析]根据题意,Cl2先氧化Fe2+,不可能只氧化Br -,B选项错误
[考点定位]本题考查氧化还原反应的先后。
1.(2013·上海化学·7)将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
|
选项 |
X |
Y |
|
A |
SO2 |
H2S |
|
B |
Cl2 |
CO2 |
|
C |
NH3 |
CO2 |
|
D |
SO2 |
Cl2 |
[答案]B
[解析]A项将SO2通入BaCl2溶液,不反应,部分O2溶解在水中后与后来通入的H2S 发生反应生成2H2S+ SO2=3S+2H2O 生成S沉淀,B项始终不反应无现象,C项反应为2NH3+ H2O+ CO2+BaCl2=2NH4Cl+BaCO3 D项发生反应:SO2+ Cl2+2H2O=H2SO4+2HCl、BaCl2+H2SO4=BaSO4+2HCl 因此选B
1、(2013·江苏化学·21B)B.[实验化 学]
学]
3,5-二甲氧基苯酚是重要的有机合成 中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
|
物质 |
沸点/℃ |
熔点/℃ |
密度(20℃) / g·cm-3 |
溶解性 |
|
甲醇 |
64.7 |
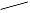 |
0.7915 |
易溶于水 |
|
乙醚 |
34 .5 .5 |
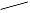 |
0.7138 |
微溶于水 |
|
3,5-二甲氧基苯酚 |
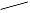 |
33~36 |
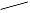 |
易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 
 并洗净,分液时有机层在分液漏斗的
并洗净,分液时有机层在分液漏斗的
 填(“上”或“下”)层。
填(“上”或“下”)层。
(2)分离得到的有机 层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是
层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是 
 ;用饱和食盐水洗涤的目的是
;用饱和食盐水洗涤的目的是
 。
。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺 序是
(填字母)。
序是
(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离 常采用减压过滤。为了防止倒吸,减压过滤完成后应先
常采用减压过滤。为了防止倒吸,减压过滤完成后应先
,再  。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com