
5.(2014·海淀模拟)下列关于实验原理或操作的叙述中,正确的是( )
①从碘水中提取单质碘时,可用无水乙醇代替CCl4
②可以用NaOH溶液除去溴苯中的溴杂质
③用酸性KMnO4溶液可以除去乙烯中混有的乙炔
④实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法
A.①② B.②③ C.①③ D.②④
解析:选D 乙醇溶于水,不能作萃取剂,①错误;Br2+2NaOH===NaBr+NaBrO+H2O,NaOH溶液可以除去杂质Br2,②正确;酸性KMnO4溶液与乙烯、乙炔均发生反应,③错误;乙酸与CaO反应生成盐,蒸馏可分离出乙醇,④正确。
4.如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )
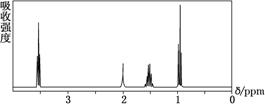
A.CH3CH2CH2CH3 B.(CH3)2CHCH3
C.CH3CH2CH2OH D.CH3CH2COOH
解析:选C 由核磁共振氢谱的定义可知,在氢谱图中从峰的个数即可推知有几种化学环境不同的氢原子,由图可知有4种不同化学环境的氢原子。分析选项可得A项有2种不同化学环境的氢原子,B项有2种不同化学环境的氢原子,C项有4种不同化学环境的氢原子,D项有3种不同化学环境的氢原子。
3.下列各化合物的命名正确的是( )
A.CH2===CH—CH===CH2 1,3二丁烯
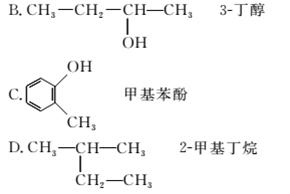
解析:选D A错误,应命名为1,3丁二烯;B错误,应离官能团—OH最近的一端编号,命名为2丁醇;C错误,—OH与—CH3邻位,命名为邻甲基苯酚或2甲基苯酚。
2.如图是某有机物分子的比例模型,有关该物质的推断不正确的是( )
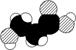
A.分子中含有羟基
B.分子中含有羧基
C.分子中含有氨基
D.该物质的分子式为C3H6O3
解析:选C 据C、H、O、N等原子的价电子排布及有机物成键特点、原子半径的比例,可知黑球为碳、浅色球为氧、白球为氢,此有机物的结构简式为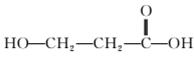 ,C错误。
,C错误。
一、选择题
1.下列物质中最简式相同,但既不是同系物,也不是同分异构体的是( )
A.CH3CH===CH2和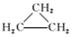
B.乙炔和苯
C.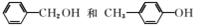
D.乙酸和甲酸甲酯
解析:选B A、C、D项中的物质分别互为同分异构体。
6.以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
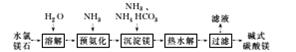
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol/L,则溶液中c(Mg2+)=___________________________。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为________.
解析:(1)Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=c(Mg2+)·(3.0×10-6)2=1.8×10-11,解得c(Mg2+)=2.0 mol/L。
(2)沉淀的成分为碱式碳酸镁,根据质量守恒关系可知滤液中得到的是NH4Cl,浓缩结晶后的固体物质化学式为NH4Cl。
答案:(1)2.0 mol/L (2)NH4Cl
5.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备 MgO 的实验方案:
|
模拟海水中的离子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl- |
HCO |
|
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于 1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6,
Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在 Mg2+,不存在Ca2+
C.滤液N中存在 Mg2+、Ca2+
D.步骤②中若改为加入 4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
解析:选A 加入 NaOH 溶液,HCO 与 OH- 反应生成 CO,此时c(Ca2+)·c(CO)= 0.011× 0.001 = 1.1× 10-5>Ksp(CaCO3),c(Mg2+)·c(CO)= 0.050 ×0.001 =5×10-5> Ksp(MgCO3),由于Ksp(CaCO3)< Ksp(MgCO3),因此先生成 CaCO3 沉淀,生成沉淀后溶液中c( CO)=Ksp(CaCO3)/c(Ca2+)=4.96×10-7mol/L<1×10-5moL/L,因此CO完全沉淀,则无 MgCO3 沉淀生成,A正确;滤液 M 中c(Ca2+)= 0.010 mol/L,c(Mg2+)= 0.050 mol/L,B错误;滤液 M 加 NaOH 固体调节 pH =11,此时c(Mg2+)·c2(OH-)=0.050 ×(10-3)2=5×10-8>Ksp[Mg(OH)2],c(Ca2+)·c2(OH-)=0.010×(10-3)2=1×10-8<Ksp[Ca(OH)2],因此只有 Mg(OH)2沉淀生成,而无 Ca(OH)2沉淀生成,生成沉淀后溶液中c(Mg2+)=Ksp[Mg(OH)2]/c2(OH-)=5.61×10-6 mol/L<1×10-5 mol/L,因此Mg2+完全沉淀,故滤液 N 中只有 Ca2+而无 Mg2+,C 错误;若改为加入 4.2 g NaOH 固体,则c(OH-)=0.105 mol/L,则 c(Mg2+)·c2(OH-)=0.050×0.1052≈5.51×10-4>Ksp[Mg(OH)2],c(Ca2+)·c2(OH-)=0.010×(0.105)2=1.10×10-4>Ksp[Ca(OH)2],由于Ksp[Mg(OH)2]<Ksp[Ca(OH)2],则先生成Mg(OH)2沉淀,并且沉淀完全,生成沉淀后溶液中 c(OH-)=0.105 mol/L-0.05 mol/L×2=0.005 mol/L,此时 c(Ca2+)·c2(OH-)=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],故无Ca(OH)2沉淀生成,D错误。
4.已知常温下反应,①NH3+H+ NH(平衡常数为K1),②Ag++Cl-
NH(平衡常数为K1),②Ag++Cl-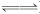 AgCl(平衡常数为K2),③Ag++2NH3
AgCl(平衡常数为K2),③Ag++2NH3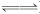 Ag(NH3)(平衡常数为K3)。①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是( )
Ag(NH3)(平衡常数为K3)。①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是( )
A.氯化银不溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银氨溶液可在酸性条件下稳定存在
解析:选C 因为K3>K2,所以Ag+与NH3的络合能力大于Ag+与Cl-之间的沉淀能力,AgCl溶于氨水,A、B错误;由于K1>K3,所以在Ag(NH3)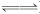 Ag++2NH3中加入HCl,有H++NH3
Ag++2NH3中加入HCl,有H++NH3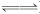 NH,致使平衡右移,c(Ag+)增大,Ag++Cl-===AgCl↓,D错误,C正确。
NH,致使平衡右移,c(Ag+)增大,Ag++Cl-===AgCl↓,D错误,C正确。
3.已知AgCl的溶解平衡:AgCl(s) 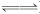 Ag+(aq)+Cl-(aq),下列说法不正确的是( )
Ag+(aq)+Cl-(aq),下列说法不正确的是( )
A.除去溶液中Ag+加盐酸盐比硫酸盐好
B.加入H2O,溶解平衡不移动
C.用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
D.反应2AgCl(s)+Na2SAg2S(s)+2NaCl说明溶解度:AgCl>Ag2S
解析:选B 加水能促进AgCl的溶解,平衡向溶解的方向移动,B错误;AgCl难溶,Ag2SO4微溶,A正确;NaCl溶液洗涤AgCl沉淀,可抑制AgCl的溶解,C正确;溶解度越小,沉淀越易转化,D正确。
2.已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
A.原AgNO3溶液的物质的量浓度为1 mol/L
B.图中x点的坐标为(100,6)
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1 mol/L的NaCl换成0.1 mol/L NaI则图像在终点后变为虚线部分
解析:选D 根据图像可知:原溶液中的pAg=-lg[c(Ag+)]=0,则c(Ag+)=1 mol/L,A正确;当x=100 mL时,Ag+恰好完全沉淀,此时溶液中c(Ag+)=c(Cl-)=10-6mol/L,则pAg=6,B正确;残留溶液中的离子浓度小于10-5 mol/L时,沉淀就达完全,x点时c(Ag+)=10-6 mol/L,C正确;把0.1 mol/L的NaCl换成 0.1 mol/L NaI,因为Ksp(AgCl)>Ksp(AgI),则溶液中的c(Ag+)应更小,pAg应更大,故虚线应高于实线,D错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com