
2.同一反应,在相同时间间隔内,用不同物质表示的反应速率,其数值和意义都不一定相同。(×)
一、判断正误
1.活化分子的碰撞都是有效碰撞。 (×)
9.用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2CuO/CuCl2400 ℃2Cl2+2H2O
对于反应A,如图是4种投料比[n(HCl)∶n(O2)分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。
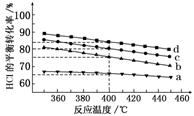
(1)曲线b对应的投料比是________。
(2)当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是________。
(3)投料比为2∶1、温度为400 ℃时,平衡混合气中Cl2的物质的量分数是________。
解析:(1)相同温度下,投料比越大,HCl的平衡转化率越小;则曲线a、b、c、d对应的投料比分别为6∶1、4∶1、2∶1、1∶1。(2)相同投料比时,温度越低,氯化氢的平衡转化率越高;HCl的平衡转化率相同时,投料比越高,对应的反应温度越低。(3)氯化氢与氧气物质的量之比为2∶1、温度为400 ℃时,氯化氢的平衡转化率为80%。
4HCl(g)+O2(g)  2H2O(g)+2Cl2(g)
2H2O(g)+2Cl2(g)
n(初始)/mol 2 1 0 0
n(转化)/mol 1.6 0.4 0.8 0.8
n(平衡)/mol 0.4 0.6 0.8 0.8
×100%=30.8%。
答案:(1)4∶1 (2)投料比越高,对应的反应温度越低
(3)30.8%

章末回扣练习(七)——化学反应速率和化学平衡
8.(2011·浙江高考节选)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。
将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据如表所示:
|
温度/℃ |
平衡总压强/kPa |
平衡气体总浓度(mol/L) |
|
15.0 |
5.7 |
2.4×10-3 |
|
20.0 |
8.3 |
3.4×10-3 |
|
25.0 |
12.0 |
4.8×10-3 |
|
30.0 |
17.1 |
6.8×10-3 |
|
35.0 |
24.0 |
9.4×10-3 |
(1)根据表中数据,列式计算25.0 ℃时的分解平衡常数:______________________________。
(2)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
解析:(1)根据K=c2(NH3)·c(CO2)=2×≈1.6×10-8。
(2)由NH2COONH4(s)2NH3(g)+CO2(g)正反应气体分子数增加,增大压强平衡向逆反应方向移动。
答案:(1)K=c2(NH3)·c(CO2)=2·=×(4.8×10-3)3≈1.6×10-8 (2)增加
7.甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g)  CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
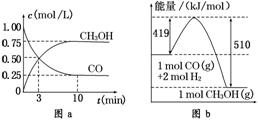
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________,CO的转化率为________。
(2)该反应的平衡常数表达式为______________________,温度升高,平衡常数________(填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向________(填“正”或“逆”)反应方向移动,理由是_________________________________________。
解析:(1)根据图a可知,反应开始到达到平衡的过程中CO的浓度变化为0.75 mol/L,所以CO的反应速率为v(CO)=0.75 mol/L÷10 min=0.075 mol/(L·min),根据反应速率之比等于化学计量数之比可知,v(H2)=2v(CO)=2×0.075 mol/(L·min)=0.15 mol/(L·min),CO的转化率为×100%=75%。
(2)该反应的平衡常数表达式为K=。根据图b可知,反应物的能量比生成物的能量高,所以正反应为放热反应,升高温度,平衡常数减小。
(3)因为反应物和生成物都是气体,反应过程中质量不变,气体的密度ρ=m/V。密度增大,说明容器的体积减小,因为反应在恒压的条件下进行,容器体积减小,说明反应后气体的物质的量减少,因为正反应方向气体体积减小,所以平衡向正反应方向移动。
答案:(1)0.15 mol/(L·min) 75%
(2)K= 减小
(3)正 反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积减小,平衡向正反应方向移动
6.在一定温度下,将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)CO(g)+H2O(g)。
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=________,反应CO2(g)+H2(g)
CO2(g)+H2(g)的平衡常数K2=________,反应CO2(g)+H2(g)  CO(g)+H2O(g)的平衡常数K3=________。
CO(g)+H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4=1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)在1 000 ℃下,某时刻CO2的物质的量为2 mol,则此时v正________v逆(填“>”、“=”或“<”)。
解析:(1)根据化学平衡常数的概念K=。
(2)K2====2,
K3==K1==。
(3)由于升高温度,该反应的平衡常数增大,故该反应为吸热反应。
(4)
CO2(g)+H2(g)  CO(g)+H2O(g)
CO(g)+H2O(g)
起始/mol: 3 2 0 0
变化/mol: 1 1 1 1
某时刻/mol: 2 1 1 1
所以c(CO)=0.5 mol/L,c(H2O)=0.5 mol/L
c(CO2)=1 mol/L,c(H2)=0.5 mol/L
故=<K1 000 ℃=1.0
反应应向正反应方向进行,所以v正>v逆。
答案:(1) (2)2 (3)吸热 (4)>
5.在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
A.5% B.10% C.15% D.20%
解析:选C N2 + 3H2 2NH3
2NH3
起始/mol 2 8 0
转化/mol 2/3 2 4/3
平衡/mol 4/3 6 4/3
平衡时氮气的体积分数为×100%≈15%。
4.700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据如表所示(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据如表所示(表中t2>t1):
|
反应时间/min |
n(CO)/mol |
n(H2O)/mol |
|
0 |
1.20 |
0.60 |
|
t1 |
0.80 |
|
|
t2 |
|
0.20 |
下列说法正确的是( )
A.反应在t1 min 内的平均速率为v(H2)= mol/(L·min)
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O 的体积分数减小
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
解析:选B A项,t1时CO减少0.40 mol,则H2增加0.40 mol,用H2表示的平均反应速率为=mol/(L·min),故错误;C项,通入H2O(g),平衡向正反应方向移动,CO转化率增大,H2O的体积分数比原来增大,故错误;D项,由表格中数据可知,从t1到t2,H2O(g)已不再改变,表明已达到平衡状态,则700 ℃时的平衡常数K==1,升温到800 ℃,平衡常数变为0.64,则表明化学平衡逆向移动,正反应是放热反应,故错误。
3.
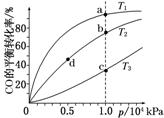
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)  CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是( )
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(a)<M(c) M(b)>M(d)
解析:选C A项,因为ΔH<0,温度越高,CO的转化率越小,所以T3>T2>T1,错误;B项,由于T3>T1,所以 v(c)>v(a),由于p(b)>p(d),所以v(b)>v(d),错误;C项,平衡常数只受温度影响,由于ΔH<0,温度越高,平衡常数越小,正确;D项,升温,平衡左移,M减小,M(a)>M(c),加压,平衡右移,M增大,M(b)>M(d),错误。
2.一定温度下 ,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),部分数据如表所示(表中t2>t1)。
CO2(g)+H2(g),部分数据如表所示(表中t2>t1)。
|
反应时间 (min) |
n(CO) (mol) |
n(H2O) (mol) |
n(CO2) (mol) |
n(H2) (mol) |
|
0 |
1.20 |
0.60 |
0 |
0 |
|
t1 |
0.80 |
|
|
|
|
t2 |
|
0.20 |
|
|
下列说法正确的是( )
A.反应在t1 min内的反应速率为v(H2)= mol/(L·min)
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20 mol
解析:选C 根据化学方程式可知在t1 min内生成0.40 mol H2,因此在t1 min内的反应速率为v(H2)== mol/(L·min),A错误;根据化学方程式可知t1、t2时刻均有n(CO)=0.80 mol,n(H2O)=0.20 mol,n(CO2)=n(H2)=0.40 mol,故表格中t1、t2时的数据均为平衡时的物质的量。据此可求出CO的平衡转化率为×100%=33.33%,B错误;由于该反应是一个气体体积不变的反应,将平衡时的物质的量代入平衡常数表达式,可计算出反应的平衡常数为1,C正确;根据平衡常数值可计算出D选项中平衡时n(CO2)=0.40 mol,D错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com