
3. (1) 比较乙醛用量不同时生成银镜的时间(速率或质量均可)
(2) 6.59min 光亮程度(或亮度、外观、效果等)
(3) 保持其他的实验条件不变,改变银氨溶液的用量,测量生成银镜的时间
(4) Fe+2H+ Fe2++H2↑ bef
Fe2++H2↑ bef
(5) 通风橱
(6) 稀硝酸
2. (1) 有红棕色气体产生 4mol·L-1NaOH溶液 用带火星的木条 带火星的木条复燃
(2) 22.4%
1. (1) 过滤 易于控制反应温度在5060℃
(2) 溶液1 副产物(或水杨酸酐、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物其中一种)
(3) 三氯化铁溶液 出现紫色 冷却至室温(或降温结晶、或冷却结晶)
(4) 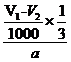 ×180×100%[或
×180×100%[或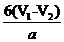 %]
%]
7. (2013·揭阳一模)漂白粉是一种常用的消毒剂。
(1) 工业上生产漂白粉的化学方程式为 ,漂白粉的有效成分为 。
(2) 某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。
限选试剂:2mol·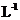 NaOH溶液、2mol·
NaOH溶液、2mol·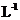 HCl溶液、2mol·
HCl溶液、2mol· HNO3溶液、0.5mol·
HNO3溶液、0.5mol· BaCl2溶液、0.01mol·
BaCl2溶液、0.01mol· AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液 |
|
|
步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入 |
现象: 结论: |
|
步骤3:取滤液分装A、B两支试管。向A试管 |
现象:溶液先变红色,然后褪色 结论: |
|
步骤4:向B试管牋 |
现象:产生白色沉淀 结论: |
(3) 探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol·L-1Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为 (只列算式,不做运算)。
已知:Ca(ClO)2+4HCl 2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2
2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2 Na2S4O6+2NaI
Na2S4O6+2NaI
专题十二 化学实验探究综合题型研究
6. (2013·江门佛山二模)SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
某兴趣小组用如右图所示装置进行Mg与SO2反应的实验。
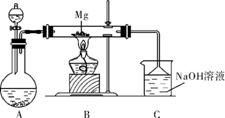
(1) 选择制取SO2的合适试剂为 (填编号)。
①浓盐酸 ②浓硫酸 ③Na2SO3固体 ④CaSO3固体
(2) 上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3) 甲同学推测Mg与SO2的反应与CO2相似,则该反应的化学方程式为 ;
乙同学的推测是2Mg+3SO2 2MgSO3+S;丙同学的推测是3Mg+SO2
2MgSO3+S;丙同学的推测是3Mg+SO2 2MgO+MgS。要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS。要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol·L-1HCl、2mol·L-1HNO3、蒸馏水、2mol·L-1NaOH、品红溶液、澄清石灰水、2mol·L-1CuSO4;仪器和用品自选。
|
序号 |
实验步骤 |
预期现象和结论 |
|
① |
取少量反应后所得固体于试管中 |
|
|
② |
向试管中的固体慢慢滴加 ,试管口塞上带导管的单孔塞,并将导管通入盛有 的试管中 |
若试管中的 ,则丙同学推测正确。若试管中的固体未完全溶解,且 ,则乙同学推测正确 |
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是 。
(4)上述实验需要100mL2mol·L-1HCl,配制时选用 (填“10mL”、“25mL”、“50mL”或“100mL”)量筒量取质量分数为36.5%、密度为1.19g·mL-1的浓盐酸的体积为 mL。
5. (2013·湛江一模)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
(1) 关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3。
假设2:沉淀是Cu(OH)2。
假设3:沉淀是 。
(2) 若假设1成立,则发生反应的离子方程式为 。
(3) 若假设2成立,原因是 。
(4) 该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。
已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。
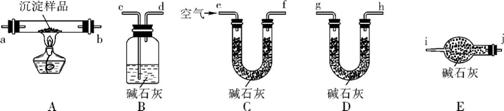
|
实验步骤 |
预期现象 |
结论 |
|
①称量B、D的质量分别为m1、m2,将装置按f→a→b→ → → → →j→i顺序连接 |
|
|
|
②称取一定质量的沉淀于 ,然后 ,冷却后再称量B、D的质量分别为m3、m4 |
a. 若m1=m3,m2<m4 b. 若m1 m3,m2 m4 c. 若m1 m3,m2 m4 |
假设1成立 假设2成立 假设3成立 |
若沉淀样品的质量为wg,装置B质量增加了ng,则沉淀中Cu(OH)2的质量分数为 。
4. (2013·江门模拟)某工厂废液中含有苯酚、乙酸苯酚酯,实验小组对该废液进行探究,设计如下方案:
废液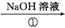 A
A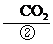
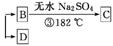
熔点:乙酸16.6℃、苯酚43℃;沸点:乙酸118℃、苯酚182℃。
(1) 写出②中发生反应的化学方程式: 。
(2) ②中分离B的操作名称是 。
(3) 现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,填写实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀硝酸、2moL·L-1NaOH、0.1mol·L-1KSCN溶液、酸性KMnO4溶液、FeCl3溶液、饱和溴水、紫色石蕊试液。
|
实验操作 |
预期现象 |
现象解释 |
|
步骤1:取少量C放入a试管,加入少量蒸馏水,振荡 |
|
|
|
步骤2:取少量C的稀溶液分装b、c两支试管,往b试管中 |
产生白色沉淀 |
|
|
步骤3:往c试管中 |
|
C与加入的试剂发生显色反应 |
3. (2013·汕头一模)乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ. 探究银镜反应的最佳实验条件的部分实验数据如下表:
|
实验变量 实验序号 |
银氨溶 液/mL |
乙醛的 量/滴 |
水浴温 度/℃ |
反应混合液的pH |
出现银镜 时间/min |
|
1 |
1 |
3 |
65 |
11 |
5 |
|
2 |
1 |
3 |
45 |
11 |
6.5 |
|
3 |
1 |
5 |
65 |
11 |
4 |
|
4 |
1 |
3 |
30 |
11 |
9 |
|
5 |
1 |
3 |
50 |
11 |
6 |
|
6 |
1 |
5 |
80 |
11 |
3 |
请回答下列问题:
(1) 读表若只进行实验1和实验3,其探究目的是 。
(2) 推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
(3) 进一步实验若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验 。
Ⅱ. 探究对废液的回收处理:
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程如下:
银氨溶液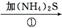
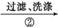
 Ag2S沉淀
Ag2S沉淀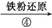 银粉
银粉
操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为Ag2S+Fe+2HCl 2Ag+FeCl2+H2S↑。
2Ag+FeCl2+H2S↑。
(4) 若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为 ;过滤需要用到的玻璃仪器有 (填编号)。
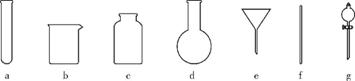
(5) 操作④应在 (填实验室设备名称)中进行。
(6) 要洗去试管壁上的银镜,采用的试剂是 (填名称)。
2. (2013·佛山一模改编)为探究Fe(NO3)2等硝酸盐热分解产物的性质,某化学小组开展如下探究:
[查阅资料] 2KNO3 2KNO2↑+O2↑ Fe(NO3)2
2KNO2↑+O2↑ Fe(NO3)2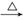 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:
(1) 探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行了如下实验,请完成实验空缺部分内容。限选试剂和用品:浓硫酸、4mol·L-1NaOH溶液、0.1mol·L-1BaCl2溶液、带火星的木条、0.1mol·L-1酸性KMnO4溶液、蒸馏水。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量Fe(NO3)2固体于试管中,加热分解 |
,说明分解产生的气体中含NO2 |
|
步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶,用 在最后一个出口检验 |
,说明分解产生的气体中含O2 |
实验二:
(2) KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:
①取混合物样品10g,充分加热分解;
②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。
则混合物中铁元素的含量为 。
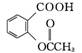
1. (2013·肇庆二模)乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药。合成原理如下:
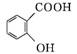 (水杨酸)+
(水杨酸)+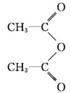

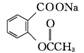
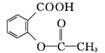 (乙酰水杨酸)+CH3COOH
(乙酰水杨酸)+CH3COOH

虚框中为提纯原理,是为了除去该反应的副产物:水杨酸酐、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物等。水杨酸(熔点158℃)和乙酰水杨酸(熔点135℃)微溶于冷水、可溶于热水和乙酸乙酯。生产流程如下:
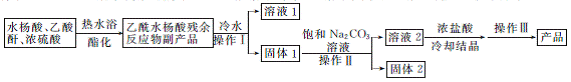
(1) 操作Ⅰ、Ⅲ的名称是 ;使用热水浴加热的原因是 。
(2) 可以循环利用的是 ;固体2的成分是 。
(3) 为了检验产品中是否含有水杨酸,并进行精制(除去产品中的其他反应物和副产物),进行以下操作,请完成下表:
|
|
操作 |
现象 |
结论 |
|
检验 |
取几粒产品晶体投入装有适量热水的试管中,振荡 |
得无色溶液 |
|
|
向试管中滴入 溶液 |
|
产品中有水杨酸 |
|
|
重结晶 |
将粗产品溶于适量的水中,水浴加热,趁热过滤,将滤液 ,抽滤有晶体析出 |
精产品 |
|
(4) 用中和法测定产品纯度:取ag产品溶解于V1mL1mol·L-1NaOH溶液中,加热使乙酰水杨酸水解,再用1mol·L-1盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2mL;计算出产品纯度为 (只需列出计算式,乙酰水杨酸的相对分子质量为180)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com