
1.
(1)
2H2O+O2+4e- 4OH- (2)
1 2 2 1
4OH- (2)
1 2 2 1
1 (3)
Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
(4) a NaClO能将Fe2+氧化为Fe3+,且NaClO溶液显碱性,能增大溶液的pH (5)①趁热过滤
②3540 ℃
8. (2011·湛江二模)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在较低温度下进行,因为在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式: ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填字母)。
A. 与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B. KOH固体溶解时会放出较多的热量,有利于提高反应速率
C. 为下一步反应提供碱性的环境
D. 使KClO3转化为 KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净? 。
(5) K2FeO4作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
Fe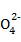 + H2O
+ H2O Fe(OH)3(胶体)+ O2↑+ OH-
Fe(OH)3(胶体)+ O2↑+ OH-
第四篇 化学工艺流程
专题十 化学工艺流程与物质的制备
7. (2011·广州调研)某同学按如下实验流程提取海带中的碘:
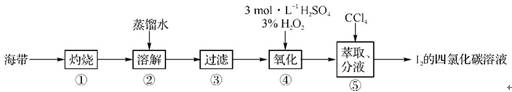
(1)第①步是将海带放入 (填仪器名称)中,用酒精灯充分加热灰化。
(2)第②步为了加快溶解速率并使碘离子充分进入溶液,可以采取的措施是 、 (写出两条)。
(3)实验进行到某一步时应检验碘的存在,具体方法是 。
(4)海带灰中还含有其他无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第 (填编号)步与碘分离的。
6. (2012·广州一模)绿矾(FeSO4·7H2O)的一种综合利用工艺如下:
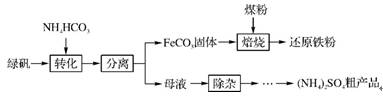
(1)绿矾与NH4HCO3在溶液中按物质的量之比1∶2反应,有CO2生成,反应的离子方程式为 。
(2)隔绝空气进行“焙烧”,铁元素的转化途径是:FeCO3 FeO
FeO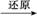 Fe,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式: 。
Fe,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式: 。
(3)“除杂”操作为:向母液中通入含臭氧的空气、调节pH、过滤,除去的杂质离子是 。
(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、 。浓缩时若温度过高,产品中将混有NH4HSO4,运用化学平衡移动原理解释其原因: 。
(5)绿矾的另一种综合利用方法是:绿矾脱水后在有氧条件下焙烧,FeSO4转化为Fe2O3和硫的氧化物。分析下表实验数据,为了提高SO3的含量,可采取的措施是 。
|
通入空气量/L·s-1 |
温度/℃ |
SO2含量/% |
SO3含量/% |
|
0.02 |
850 |
45.4 |
54.6 |
|
0.06 |
850 |
30.5 |
69.5 |
|
0.10 |
850 |
11.1 |
88.9 |
|
0.10 |
810 |
11.1 |
88.9 |
|
0.10 |
890 |
11.2 |
88.8 |
5. 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、Ba(FeO2)2等]。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
(1)酸溶后溶液的pH=1,分别写出BaSiO3、Ba(FeO2)2与HNO3反应的离子方程式: 。
(2)酸溶时通常控制反应温度不超过70 ℃,且不使用浓硝酸,原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减小(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。
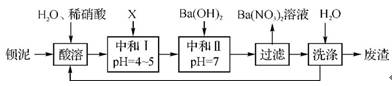
4. (2011·北京高考)氯碱工业中电解饱和食盐水的原理示意图如右图所示。
(1)溶液A的溶质是 。
(2)电解饱和食盐水的离子方程式是 。
(3)电解时用盐酸控制阳极区溶液的pH在23,用化学平衡移动原理解释盐酸的作用: 。
(4)电解所用的盐水需精制,以去除有影响的Ca2+、Mg2+、N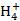
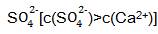 。精制流程如下(淡盐水和溶液A来自电解池):
。精制流程如下(淡盐水和溶液A来自电解池):
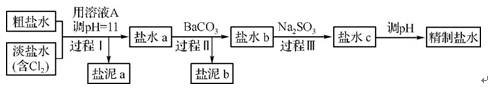
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将N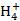
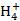 转化为N2的离子方程式是 。
转化为N2的离子方程式是 。
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 。
④经过程Ⅲ处理,要求盐水中c中剩余Na2SO3的含量小于5 mg·L-1,若盐水b中的NaClO的含量是7.45 mg·L-1,则处理10 m3盐水b,最多添加10% Na2SO3溶液 kg。(溶液体积变化忽略不计)
3. (2012·新课标全国高考)由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
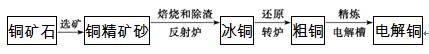
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是 、 ;反射炉内生成炉渣的主要成分是 。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%50%。在转炉中,将冰铜加熔剂(石英砂)在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 。
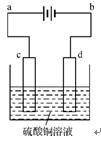
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
2. (2012·惠州一调)医用氯化钙可用于补钙、抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.3%103.0%),工艺流程如下:
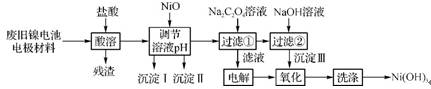
(1) CaCO3与盐酸反应的离子方程式为 。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。滤渣主要成分的化学式为 。
(3)酸化时加盐酸的目的是:
① 。
②防止Ca2+在蒸发时发生水解。
(4)蒸发结晶要保持在160 ℃的原因: 。
(5)为测定样品中CaCl2·2H2O的含量,称取0.752 2 g样品并配成250 mL溶液,分别取该溶液25.00 mL于三个锥形瓶中,用0.04 mol·L-1 AgNO3溶液进行三次滴定,消耗AgNO3溶液的平均体积为20.39 mL。
①通过计算,样品中含CaCl2·2H2O的质量分数为 (只列出计算式不必计算结果)。
②若所测样品中CaCl2·2H2O的质量分数偏高(忽略其他实验误差),可能的原因是(写一种) 。
1. (2012·肇庆一模)某炼铁废渣中含有大量CuS及少量的铁和铁的化合物,工业上以该废渣为原料生产CuCl2·2H2O的流程如下:
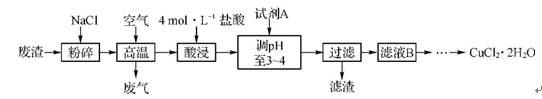
请回答下列问题:
(1)废渣中的铁在潮湿的空气中发生吸氧腐蚀,其正极反应式为 。
(2)高温煅烧时CuS发生的反应如下,配平该化学方程式。
CuS+ NaCl+ O2 CuCl2+ Na2SO4
CuCl2+ Na2SO4
(3)调pH后铁元素生成滤渣的离子方程式为 。
(4)试剂A最好选用下列三种物质中的 (填字母)。
a. NaClO b. Cl2 c. 浓硫酸
理由是 。
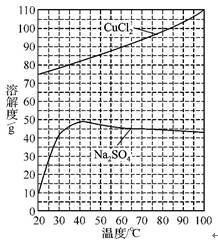
(5)分析右图所示溶解度曲线,回答有关问题:
①为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:蒸发浓缩、 、滤液冷却结晶、过滤得到产品。
②“冷却结晶”过程中,析出CuCl2·2H2O晶体的合适温度或温度范围是 。
12. BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com