
4. (2013·苏锡常镇二模)CaC2可用于固氮:CaC2+N2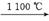 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1) 写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2) C、N、O三种元素的第一电离能由小到大的顺序是 。
(3) NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测C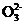 的空间构型为
。
的空间构型为
。
(4) CaCN2中阴离子为C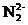 ,与C
,与C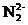 互为等电子体的分子有 (填写一种化学式);写出CaCN2水解反应的化学方程式: 。
互为等电子体的分子有 (填写一种化学式);写出CaCN2水解反应的化学方程式: 。
3. KSCN是一种重要的试剂,它可由氰化钾(KCN)与硫共热制得,实验室常用来检验Fe3+。
(1) 写出基态Fe3+的电子排布式: 。
(2) 氰化钾(KCN)是一种剧毒物质。下列说法正确的是 (填字母)。
a. CN-的电子式为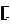 C⋮⋮
C⋮⋮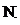 ]-
]-
b. 气体(CN)2的结构式为N≡C—C≡N
c. HCN中C原子采用sp3杂化
(3) HSCN是一种弱酸,该酸分子中含有的σ键与π键个数之比为 。Fe3+与SCN-生成的配离子中,配位数可以在16之间,写出配位数为5的化学式: 。C、N、O三种元素的第一电离能由大到小的顺序为 ;C、N、O的电负性由大到小的顺序为 。
(4) 写出与SCN-互为等电子体的分子或离子: 。
2. 铜锰氧化物(CuMnO4)可以在常温下催化氧化空气中的一氧化碳和甲醛,因而对新装修的住房有益。
(1) 基态Cu2+的电子排布式为 。
(2) 甲醛(HCHO)中C原子的杂化方式为 ,它的空间构型为 ,1mol甲醛分子中含 mol σ键。
(3) CO常与金属形成羰基化合物,Fe(CO)5的结构示意图是 ;与CO互为等电子体的分子、离子分别是 、 。
1. (2013·常州一模)A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥型;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E的电负性小于F。
(1) 写出B的基态原子的核外电子排布式: 。
(2) A、C形成的分子极易溶于水,其主要原因是 ;与该分子互为等电子体的阳离子为 。
(3) 比较E、F的第一电离能:E (填“>”或“<”)F。
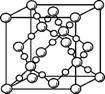
(4) BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于 (填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化方式为 。
(5) 光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在 (填字母)。
a. 共价键 b. 非极性键 c. 配位键 d. σ键 e. π键
2. (1) 只显+3价
(2) ①溶液呈血红色 ②溶液紫红色不褪去
(3) 4Fe(NO3)2 2Fe2O3+8NO2↑+O2↑
2Fe2O3+8NO2↑+O2↑
1. (1) NaClO+CO2+H2O NaHCO3+HClO
NaHCO3+HClO
4. (1) BaSO4+4C BaS+4CO↑ (2)
a
BaS+4CO↑ (2)
a
解析 根据题意以及反应物,可推断出还原性气体为CO。C与O2反应放热,可以维持反应所需要的高温。
[典题演示]
变式训练1 B
变式训练2 B
变式训练3 (1) Cr2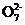 +6Fe2++14H+
+6Fe2++14H+ 2Cr3++6Fe3++7H2O (2)
13.9
2Cr3++6Fe3++7H2O (2)
13.9
变式训练4 (1) Fe
(2) FeCl2+2H2O Fe(OH)2+2HCl、4Fe(OH)2+O2+2H2O
Fe(OH)2+2HCl、4Fe(OH)2+O2+2H2O 4Fe(OH)3、2Fe(OH)3
4Fe(OH)3、2Fe(OH)3 Fe2O3+3H2O(或4FeCl2+4H2O+O2
Fe2O3+3H2O(或4FeCl2+4H2O+O2 2Fe2O3+8HCl)
2Fe2O3+8HCl)
[课堂评价]
3. (1) CuO+2H+ Cu2++H2O
Cu2++H2O
(2) 将Fe2+氧化成Fe3+ Fe(OH)3
2. C
1. D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com