
41. (1) CO2+NH3+NaCl+H2O NaHCO3↓+NH4Cl (2)
增大硫黄与空气的接触面积,使硫黄充分燃烧,反应速率加快 CO2、H2O (3)
2∶1 Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低
NaHCO3↓+NH4Cl (2)
增大硫黄与空气的接触面积,使硫黄充分燃烧,反应速率加快 CO2、H2O (3)
2∶1 Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低
(4) S2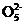 +2H+
+2H+ 2SO2↑+H2O
2SO2↑+H2O
80. 铁和铝是我们日常生活中应用最广泛的金属材料。
(1) 已知:2Fe(s)+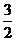 O2(g)
O2(g) Fe2O3(s) ΔH=-823.7kJ·mol-1
Fe2O3(s) ΔH=-823.7kJ·mol-1
2Al(s)+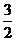 O2(g)
O2(g) Al2O3(s) ΔH=-1675.7kJ·mol-1
Al2O3(s) ΔH=-1675.7kJ·mol-1
写出铝热反应的热化学方程式: ,该反应常用于焊接铁轨,理由是 。
(2) 工业上用Al Si
Si Fe合金在一定条件下还原白云石[主要成分为CaMg(CO3)2]可制取金属镁。实际生产中镁的还原率在不同条件下的变化曲线如图1、图2所示。
Fe合金在一定条件下还原白云石[主要成分为CaMg(CO3)2]可制取金属镁。实际生产中镁的还原率在不同条件下的变化曲线如图1、图2所示。
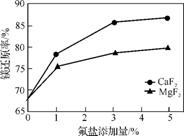
图1
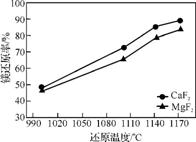
图2
①实际生产中通过添加氟盐来提高镁的还原率,选择最佳的氟盐及添加量是 。
②温度一般控制在1140℃,原因是 。
③若将一定质量的Al Si
Si Fe合金投入100mLamol·L-1硫酸(过量)中,充分反应后过滤,向滤液中加入5mol·L-1氢氧化钠溶液,当加到200mL时生成的沉淀量最大,则a的值为 。
Fe合金投入100mLamol·L-1硫酸(过量)中,充分反应后过滤,向滤液中加入5mol·L-1氢氧化钠溶液,当加到200mL时生成的沉淀量最大,则a的值为 。
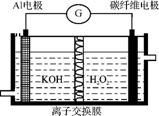
图3
(3) 大功率Al H2O2动力电池原理如图3所示,电池放电时负极的Al转化为Al
H2O2动力电池原理如图3所示,电池放电时负极的Al转化为Al 。透过离子交换膜的离子为 ,该电池反应的离子方程式为 。
。透过离子交换膜的离子为 ,该电池反应的离子方程式为 。
非选择题(40题)
[工艺流程]
79. 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g) 6CO(g)+8H2O(l) ΔH=-2
741.8 kJ·mol-1
6CO(g)+8H2O(l) ΔH=-2
741.8 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH=-566.0 kJ·mol-1
2CO2(g) ΔH=-566.0 kJ·mol-1
(1) 反应C3H8(g)+5O2(g) 3CO2(g)+4H2O(l)的ΔH= 。
3CO2(g)+4H2O(l)的ΔH= 。
(2) C3H8在不足量的氧气中燃烧,生成CO、CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
①下列事实能说明该反应达到平衡的是 (填字母)。
A. 体系中的压强不发生变化 B. v正(H2)=v逆(CO)
C. 混合气体的密度不发生变化 D. CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质的浓度随时间变化如下表:
|
时间/min |
CO/mol·L-1 |
H2O(g)/mol·L-1 |
CO2/mol·L-1 |
H2/mol·L-1 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
c1 |
|
6 |
0.096 |
0.266 |
0.104 |
c2 |
第56 min时的数据是保持温度和体积不变,改变某一条件后测得的。第56 min时,改变的条件是 。
已知420℃时该化学反应的平衡常数为9,如果反应开始时,CO和H2O(g)的浓度都是0.01 mol·L-1,则CO在此条件下的转化率为 。又知397℃时该反应的平衡常数为12,请判断该反应的ΔH (填“>”、“=”或“<”)0。
(3) 依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。电池负极的电极反应式为 。
(4) 用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为 。
78. 能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ. CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0
kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0
kJ·mol-1
Ⅱ. CO(g)+2H2(g) CH3OH(g) ΔH=-129.0
kJ·mol-1
CH3OH(g) ΔH=-129.0
kJ·mol-1
(1) CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2) 将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
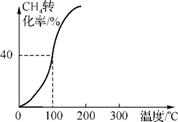
①假设100℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应Ⅰ的平衡常数为 。
(3) 在压强为0.1 MPa、温度为300℃条件下,1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应 Ⅱ 生成甲醇,平衡后将容器的容积压缩到原来的容积,其他条件不变,对平衡体系产生的影响是 (填字母)。
A. c(H2)减小 B. 正反应速率加快,逆反应速率减慢
C. CH3OH的物质的量增加 D. 重新平衡时反应速率加快
E. 平衡常数K增大
(4) 甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程。
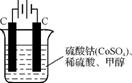
①写出阳极的电极反应式: 。
②写出除去甲醇的离子方程式: 。
77. 碳氧化物和氨氧化物在工业生产中有着广泛应用。
(1) 工业上利用CO和H2在催化剂存在下合成甲醇。
主反应:CO(g)+2H2(g) CH3OH(g) ΔH=-91
kJ·mol-1
CH3OH(g) ΔH=-91
kJ·mol-1
副反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-206 kJ·mol-1
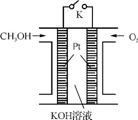
图1
①反应2CH3OH(g) CH3OCH3(g)+H2O(g)的ΔH= kJ· mol-1。
CH3OCH3(g)+H2O(g)的ΔH= kJ· mol-1。
②工业中常用醇为燃料制成燃料电池(如图1所示),通入空气的电极是 (填“正”或“负”)极;该电池的负极反应式为 。
(2) 氮氧化物进入大气后,可形成硝酸型酸雨和光化学烟雾,必须对其进行处理。
①用过量的NaOH溶液吸收NO2气体,所得的溶液中除了含有NaOH和NaNO2,还含有 。
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示。写出净化过程中的总反应化学方程式: 。
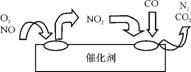
图2
③某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发生的反应如下:
6NOx+4xNH3 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
若处理1×104 L(标准状况)该尾气需42.5 g NH3,则x= 。
76. 钢铁工业是国民经济的重要基础产业,是日常生活中使用最广泛的金属材料之一。
(1) 用天然气冶铁,第一步是天然气的重整反应并制得水煤气。相关反应的热化学方程式如下:
CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206kJ·mol-1
CO(g)+3H2(g) ΔH=+206kJ·mol-1
CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247.4kJ·mol-1
2CO(g)+2H2(g) ΔH=+247.4kJ·mol-1
①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=
kJ·mol-1。
H2(g)+CO2(g) ΔH=
kJ·mol-1。
②制取水煤气时,常向反应器中通入一定比例空气,使部分CH4燃烧,其目的是 。
(2) ①天然气冶铁的第二步是用第一步的产物还原铁矿石,结合两步反应,从物质转化考虑,该冶铁工艺的优点是 。
②渗、脱碳反应原理为3Fe(s)+CH4(g)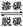 Fe3C(s)+2H2(g),若在910℃时渗碳(此时反应的平衡常数为K1),渗碳过程中,气体浓度及K1之间应满足的关系的是 。
Fe3C(s)+2H2(g),若在910℃时渗碳(此时反应的平衡常数为K1),渗碳过程中,气体浓度及K1之间应满足的关系的是 。
(3) 用生铁炼钢时,需要吹入纯氧氧化杂质,并加生石灰脱硫、磷,加脱氧剂脱氧。
①用金属铝脱氧时,Al与FeO在高温下反应的化学方程式为 。
②脱氧时,铝耗、吹氧时间、钢水温度变化之间关系如图1,钢水温度升高的主要原因是 。
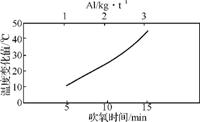
图1
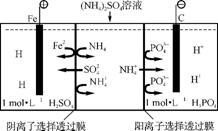
图2
(4) 一种阴、阳离子双隔膜三室电解槽,以铁作阳极,碳作阴极,可使废水中N 在某一室富集。模拟装置如图2。下列说法正确的是 (填字母)。
在某一室富集。模拟装置如图2。下列说法正确的是 (填字母)。
a. 阳极的电极反应式为Fe-2e- Fe2+
Fe2+
b. 阴极的电极反应式为4OH--4e- 2H2O+O2↑
2H2O+O2↑
c. 电解一段时间后,阳极室主要成分为H2SO4和FeSO4
d. 电解一段时间后,阴极室一定是(NH4)3PO4
75. 氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物。
(1) 氨可用于制造氮肥、硝酸等。
①合成氨工业中,“造气”有关反应的热化学方程式如下:
C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4
kJ·mol-1
CO(g)+H2(g) ΔH1=+131.4
kJ·mol-1
C(s)+2H2O(g) CO2(g)+2H2(g) ΔH2=+90.2 kJ·mol-1
CO2(g)+2H2(g) ΔH2=+90.2 kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
则ΔH3= 。
②在一密闭容器中,加入物质的量之比为1∶3的N2与H2,在不同温度、压强下测得平衡体系中NH3的物质的量分数如图1所示。则温度为400℃、压强500×105 Pa时,H2的平衡转化率最接近 (填字母)。
A. 89% B. 75% C. 49% D. 34%
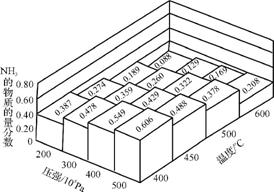
图1
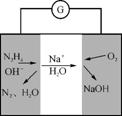
图2
③实际生产中,合成氨的温度一般控制在400500℃,选择该温度范围的理由是 。
(2) 肼可用于火箭燃料、制药原料等。
①次氯酸钠与过量的氨反应可以制备肼,该反应的化学方程式为 。
②一种肼燃料电池的工作原理如图2所示。该电池工作时负极的电极反应式为 。
③肼与亚硝酸(HNO2)反应可生成叠氮酸。8.6 g叠氮酸完全分解可放出6.72 L氮气(标准状况),则叠氮酸的分子式为 。
74. 镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
①电解无水氯化镁法 ②碳或碳化钙热还原法 ③皮江法
已知:MgCl2(l) Mg(l)+Cl2(g) ΔH=+642kJ·mol-1
Mg(l)+Cl2(g) ΔH=+642kJ·mol-1
MgO(s)+C(s) CO(g)+Mg(g) ΔH=+641.5kJ·mol-1
CO(g)+Mg(g) ΔH=+641.5kJ·mol-1
CaO(s)+3C(s) CaC2(s)+CO(g) ΔH=+464.0kJ·mol-1
CaC2(s)+CO(g) ΔH=+464.0kJ·mol-1
(1) 写出MgO(s)与CaC2(s)作用生成Mg(g)、CaO(s)、C(s)的热化学方程式: 。
(2) 碳化钙还原氧化镁的文献资料如下表:
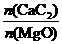 |
还原温度/℃ |
恒温时间/h |
还原率/% |
|
1.1 |
1110 |
2.0 |
65 |
|
1.1 |
1150 |
2.0 |
80 |
|
1.1 |
1150 |
2.5 |
85 |
|
1.2 |
1000 |
2.0 |
33 |
|
1.2 |
1150 |
2.0 |
84 |
|
1.2 |
1150 |
2.5 |
88 |
|
1.3 |
1150 |
2.0 |
86 |
|
1.3 |
1150 |
2.0 |
88 |
实际生产中只采取恒温2h,其主要原因是 ;采用 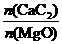 配比为1.2,而不是1.3,其主要原因是 。
配比为1.2,而不是1.3,其主要原因是 。
(3) 用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离反应:Mg(OH)Cl Mg(OH)++Cl-。电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为 。实验室由MgCl2·6H2O制取无水氯化镁可采用的方法是 。
Mg(OH)++Cl-。电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为 。实验室由MgCl2·6H2O制取无水氯化镁可采用的方法是 。
(4) 我国目前生产金属镁主要用皮江法生产,其原料为白云石(MgCO3·CaCO3)的煅烧产物和硅铁(含75%Si)。其生产原理如下:
2CaO+2MgO(s)+Si(s)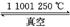 2Mg(g)+Ca2SiO4(s)
2Mg(g)+Ca2SiO4(s)
采用真空操作除了能降低操作温度外,还具有的优点是 。
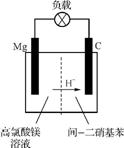
(5) 镁/间二硝基苯电池的装置如右图所示,电池工作时镁转变为氢氧化镁,间二硝基苯则转变为间二苯胺。该电池正极的电极反应式为 。
73. 在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。
(1) N2(g)+O2(g) 2NO(g) ΔH=+180.5
kJ·mol-1
2NO(g) ΔH=+180.5
kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221.0 kJ·mol-1
2CO(g) ΔH=-221.0 kJ·mol-1
C(s)+O2(g) CO2(g)
ΔH=-393.5 kJ·mol-1
CO2(g)
ΔH=-393.5 kJ·mol-1
写出NO(g)与CO(g)反应的热化学方程式: 。
(2) 某研究性学习小组在技术人员的指导下,在某温度时按下列流程探究催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:
汽车尾气 尾气分析仪
尾气分析仪 催化反应器
催化反应器 尾气分析仪
尾气分析仪
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/×10-4mol·L-1 |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
|
c(CO)/×10-3mol·L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
①前2s内的平均反应速率v(N2)= 。
②该温度下,反应的平衡常数K= 。
③对于该可逆反应,下列叙述正确的是 (填字母)。
A. 该反应在一定条件下能自发进行
B. 该反应能有效减少有害气体的排放
C. 该反应一旦发生将在很短的时间内完成
D. 该反应达到平衡时CO、NO的转化率相等

(3) CO分析仪以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇 氧化钠,其中O2-可以在固体介质NASICON中自由移动。
氧化钠,其中O2-可以在固体介质NASICON中自由移动。
下列叙述错误的是 (填字母)。
A. 负极的电极反应式为CO+O2--2e- CO2
CO2
B. 工作时O2-在固体介质中由电极a流向电极b
C. 工作时电子由电极a通过电流计流向电极b
D. 电流计中显示的电流越大,汽车尾气中CO的含量越高
72. 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1) 工业生产甲醇的常用方法是CO(g)+2H2(g) CH3OH(g) ΔH1=-90.8
kJ·mol-1。
CH3OH(g) ΔH1=-90.8
kJ·mol-1。
已知:2H2(g)+O2(g) 2H2O
(l) ΔH2=-571.6 kJ·mol-1
2H2O
(l) ΔH2=-571.6 kJ·mol-1
H2(g)+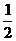 O2(g)
O2(g) H2O(g) ΔH3=-241.8
kJ·mol-1
H2O(g) ΔH3=-241.8
kJ·mol-1
①H2的燃烧热为 kJ·mol-1。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热ΔH= 。
CO(g)+2H2O(g)的反应热ΔH= 。
③若在恒温恒容的容器内进行反应:CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
A. CO百分含量保持不变
B. 容器中H2浓度与CO浓度相等
C. 容器中混合气体的密度保持不变
D. CO的生成速率与CH3OH的生成速率相等
(2) 工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是 。
CO(g)+2H2(g),此反应能自发进行的原因是 。
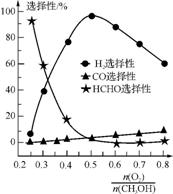
②甲醇部分氧化法。在一定温度下,以Ag/CeO2 ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如右图所示。则当
ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如右图所示。则当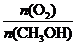 =0.25时,CH3OH与O2发生的主要反应的化学方程式为 ;在制备H2时最好控制
=0.25时,CH3OH与O2发生的主要反应的化学方程式为 ;在制备H2时最好控制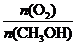 = 。
= 。
(3) 在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com