
25. 研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO +2Ag+2NaCl=Na
+2Ag+2NaCl=Na Mn
Mn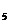 O
O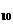 +2AgCl。下列“水”电池在海水中放电时的有关说法正确的是
+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是
A. 正极反应式:Ag+Cl -e
-e =AgCl
=AgCl
B. 每生成1 mol Na Mn
Mn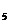 O
O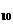 转移2 mol电子
转移2 mol电子
C. Na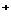 不断向“水”电池的负极移动
不断向“水”电池的负极移动
D. AgCl是还原产物
第Ⅱ卷(非选择题 共50分)
非选择题(本题包括6小题,共50分)
24. 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
A-A |
B-B |
A-B |
|
生成1mol化学键时放出的能量 |
436kJ·mol 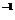 |
243 kJ·mol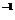 |
431 kJ·mol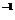 |
则下列热化学方程式不正确的是
A. 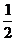 A
A (g)+
(g)+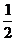 B
B (g)=AB(g) △H=-91.5 kJ·mol
(g)=AB(g) △H=-91.5 kJ·mol
B. A (g)+ B
(g)+ B (g)=2AB(g) △H=-183 kJ·mol
(g)=2AB(g) △H=-183 kJ·mol
C. 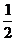 A
A (g)+
(g)+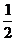 B
B (g)=AB(g) △H=+91.5 kJ·mol
(g)=AB(g) △H=+91.5 kJ·mol
D. 2AB(g)= A (
( g)+
g)+ B
B (g) △H=+183 kJ·mol
(g) △H=+183 kJ·mol
23. 在100mL H SO
SO
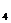 与CuSO
与CuSO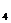 的混合液中,用石墨作电极电解,两极上均收集到2.24L气体(标准状况),则原混合溶液中Cu
的混合液中,用石墨作电极电解,两极上均收集到2.24L气体(标准状况),则原混合溶液中Cu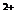 的物质的量浓度为
的物质的量浓度为
A. 1 mol·L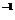 B. 2
mol·L
B. 2
mol·L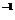 C.
3 mol·L
C.
3 mol·L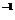 D.
4 mol·L
D.
4 mol·L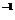
22. 下列叙述中不正确的是
A. 一定浓度的硫酸铝溶液可使石蕊溶液变红,其原因是发生了如下反应;
Al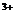 +3H
+3H O
O Al(OH)
Al(OH)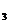 +3H
+3H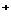 ,使得溶液中的c(H
,使得溶液中的c(H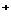 )>c(OH)
)>c(OH)
B. 在常温下,10mL 0.02mol·L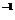 盐酸与10mL0.02mol·L
盐酸与10mL0.02mol·L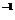 Ba(OH)
Ba(OH) 溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C. 在0.1 mol·L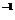 NH
NH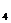 Cl溶液中,c(H
Cl溶液中,c(H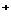 )+c(NH
)+c(NH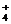 )=c(Cl
)=c(Cl )+c(OH
)+c(OH )
)
D. 5 mL 1 mol·L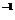 CH
CH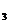 COONa溶液与5mL 1 mol·L
COONa溶液与5mL 1 mol·L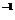 盐酸混合液中:c(Cl
盐酸混合液中:c(Cl )
) >c(Na
>c(Na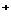 )>c(H
)>c(H )>c(OH
)>c(OH )
)
21. 茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
①铝合金是阳极 ②铝合金是负极
③海水是电解质溶液 ④铝合金电极发生还原反应
A. ②③ B. ②④ C. ①② D. ①④
20. 下列叙述正确的是
A. pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B. 溶液中c(H )越大,pH也越大,溶液的酸性就越强
)越大,pH也越大,溶液的酸性就越强
C. 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
19. 用惰性电极电解下列 溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是
溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是
A. CuCl (CuO) B.
NaOH(NaOH) C.
CuSO
(CuO) B.
NaOH(NaOH) C.
CuSO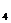 (CuO) D.
NaCl(NaOH)
(CuO) D.
NaCl(NaOH)
18. 观察下列几个装置示意图,有关叙述正确的是
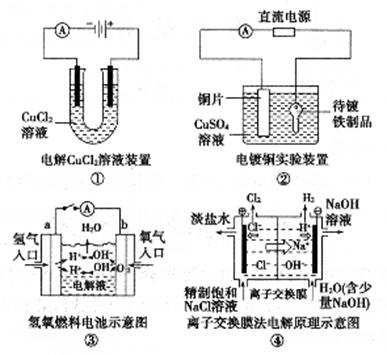
A. 装置①中阳极上析出红色固体
B. 装置②的待镀铁制品应与电源正极相连
C. 装置③闭合电键后,外电路电子由a极流向b极
D. 装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
17. 如图所示,下列叙述正确的是
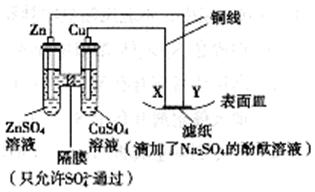
A. X为正极,发生氧化反应
B. Y为阴极,发生还原反应
C. Y与滤纸接触处有氧气生成
D. X与滤纸接触处变红
16. 将标准状况下1.12L CO 通入含有2g NaOH的水溶液中,完全反应并得到2L溶液,则对于该溶液的表述正确的是
通入含有2g NaOH的水溶液中,完全反应并得到2L溶液,则对于该溶液的表述正确的是
A. c(Na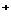 )=c(HCO
)=c(HCO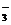 )+c(CO
)+c(CO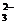 )+c(H
)+c(H CO
CO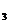 )
)
B. c(Na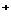 )+c(H
)+c(H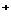 )=c(HCO
)=c(HCO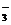 )+c(CO
)+c(CO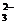 )+c(OH
)+c(OH )
)
C. HCO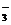 的电离程度大于HCO
的电离程度大于HCO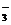 的水解程度
的水解程度
D. 发生的化学反应是:2NaOH+CO =Na
=Na CO
CO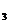 +H
+H O
O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com