
2、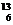 C-NMR(核磁共振)可以用于含碳化合物的结构分析有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析有关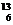 C的说法正确的是
C的说法正确的是
A、质子数为6 B、电子数为13 C、中子数为6 D、质量数为6
一、单项选择题
1、通常用于衡量一个国家石油化工发展水平的标志是
A、石油的产量 B、乙烯的产量 C、天然气的产量 D、硫酸的产量
8.[解析](1)①c(A、起)=0.04 mol·L-1,由v(A)可得Δc(A)=0.
mol·L-1,由v(A)可得Δc(A)=0. 018 mol·L-1,c(A、末)=c(A、起)-Δc(A)=0.022
mol·L-1;由化学方程式知:c(C)=Δc(C)=
018 mol·L-1,c(A、末)=c(A、起)-Δc(A)=0.022
mol·L-1;由化学方程式知:c(C)=Δc(C)=
Δc(A)=0.018 mol·L-1,则n(C)=0.018 mol·L- 1×5 L=0.09 mol。
1×5 L=0.09 mol。
②设达到平衡时A变化的浓度为cmol·L-1
A(g) + B(g)  C(g) + D(g)
C(g) + D(g)
起始浓度
(mol·L-1) 0.04 0.16 0 0
变化浓度
(mol·L-1) c c c c
平衡浓度
(mol·L-1) 0.04-c 0.16-c c c
由题意知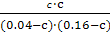 =1,解之得c=0.032,A的转化率为
=1,解之得c=0.032,A的转化率为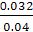 ×100%=80%。
×100%=80%。
(2)a、b、d本来就是不会随反应进行而变化的量,不能作为平衡的标志。
答案:(1)①0.022 0.09 ②80% (2)c
关闭Word文档返回原板块
7.[解析](1)在0 min~1 min、1 min~2 min、2 min~3 min、3 min~4 min、4 min~ 5 min时间段中,产生氢气的体积(mL)分别是50、70、112、58、20,2 min~3 min时间段中,反应速率最大,因为该反应是放热反应,此时溶液的温度最高;
5 min时间段中,产生氢气的体积(mL)分别是50、70、112、58、20,2 min~3 min时间段中,反应速率最大,因为该反应是放热反应,此时溶液的温度最高;
4 min~5 min时间段中,反应速率最小,因为此时反应物的浓度最小。
(2)在2 min~3 min时间段内,用盐酸的浓度变化表示的反应速率为112 mL×10-3L·mL-1÷22.4 L·mol-1×2÷0.1 L÷1 min=0.1 mol·L-1·min-1。
(3)Na2SO4不参与化学反应,故Na2SO4溶液相当于水,溶液体积增大,氢离子浓度减小,反应速率减小;加入NaNO3溶液时,溶液中存在硝酸,不再与锌反应产生氢气;加入Na2CO3溶液会消耗稀盐酸,使产生的氢气减少;加入CuSO4溶液,会构成原电池,加快反应速率。
答案:(1)2 min~3 min 该反应是放热反应,2 min~3 min时溶液温度最高,反应速率最快 4 min~5 min 此时反应物的浓度最小,反应速率最慢
(2)0.1 mol·L-1·min-1
(3)A、B
[技法小结]表示化学反应速率的常用方法
(1)单位时间内产生气体的体积。单位时间内产生的气体越多,则反应速率越快。
(2)产生单位体积的气体所用时间的长短。产生单位体积的气体所用时间越长,则反应速率越慢。
(3)单位时间内某固体反应物的质量减少量。单位时间内某反应物的质量减少越多,则反应速率越快。
(4)测定相同条件下溶液褪色所用的时间长短(针对有色溶液)。相同条件下溶液褪色所用的时间越长,则反应速率越慢。
(5)测定相同条件下溶液产生浑浊所用的时间长短(针对有沉淀产生的反应)。相同条件下产生沉淀所用的时间越长,则反应速率越慢。
6.[解析]选A。单位时间内生成A、生成B表示的都是逆反应方向,故②不是作为反应达到平衡的标志;可逆反应达到平衡时,各成分的浓度保持不变,并非等于化学计量数之比,故⑧不是作为反应达到平衡的标志。
[技法小结]判定化学平衡状态的标志
(1)利用速率相等进行判定时的两个要素:①分别表示正、逆方向,②变化量符合化学计量数之比。
(2)混合气体的 物质的量、压强、密度和平均相对分子质量不变时,能否作为反应达到平衡的标志,取决于该物理量随反应的进行是否变化。若该物理量随反应的进行变化,当该物理量不变时说明反应已经达到平衡。
物质的量、压强、密度和平均相对分子质量不变时,能否作为反应达到平衡的标志,取决于该物理量随反应的进行是否变化。若该物理量随反应的进行变化,当该物理量不变时说明反应已经达到平衡。
5.[解析]选A。从图中可以看出,pH=2和pH=7在50 min时,R的浓度都等于零,降解率为100%,A选项正确;影响R降解速率的因素除了溶液酸性外还有浓度,故B、C两项错误;在20 min~25 min,p H=10的R其浓度变化量为(0.6-0.4)×10-4mol·L-1=2×10-5mol·L-1,则v(R)=
H=10的R其浓度变化量为(0.6-0.4)×10-4mol·L-1=2×10-5mol·L-1,则v(R)=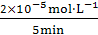 =4×10-6mol·L-1·min-1。
=4×10-6mol·L-1·min-1。
4.[解析]选B、D。反应开始时,反应物浓度最大,正反应速率最大,生成物浓度为零,逆反应速率为零,A正确;随着反应的进行,反应物浓度逐渐减小,正反应速率 逐渐减小,生成物的浓度逐渐增大,逆反应速率逐渐增大,但可逆反应不能进行到底,故反应速率不能为零,B错误,C正确;可逆反应达到平衡状态时正逆反应速率相等,D错误。
逐渐减小,生成物的浓度逐渐增大,逆反应速率逐渐增大,但可逆反应不能进行到底,故反应速率不能为零,B错误,C正确;可逆反应达到平衡状态时正逆反应速率相等,D错误。
3.[解析]选A。加水稀释到50 mL后,A、B浓度相同,但A比B温度高,A、C温度相同但C的浓度小,D温度低、浓度小,故反应最快的是A。要注意开始时的溶液体积不同,加水均稀释到50 mL,浓度的变化很大。
2.[解析]选C。v(H2)=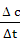 ⇒Δc=0.12×10=1.2(mol·L-1)
⇒Δc=0.12×10=1.2(mol·L-1)
N2 + 3H2  2NH3
2NH3
起始浓度
(mol·L-1) 2 2 0
变化浓度
(mol·L-1) 0.4 1.2 0.8
10 s时浓度
(mol·L-1) 2-0.4 2-1.2
=1.6 =0.8
所以10 s时的N2的物质的量为1.6 mol·L-1×2 L=3.2 mol。
1.[解析]选B。可逆反应是指在相同条件下,能同时向正、逆反应方向进行的反应。可逆反应强调两点:相同条件和同时双向进行,B正确;A项中没有说明相同条件和同时进行;C项,由于是可逆反应,所以其反应物的转化率不可能达到100%;D项中的两组反应,由于反应条件不同,不能称为可逆反应,错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com