
4.在光照条件下,将1 mol CH4与1 mol Cl2混合充分反应后,得到的产物是( )
A、CH3Cl HCl B、CCl4 HCl
C、CH3Cl CH2Cl2 D、CH3Cl CH2Cl2 CHCl3 CCl4 HCl
3.下列化学用语的书写正确的是 ( )
A.乙酸的分子式:C2H4O2 B.乙醇的结构简式:C2H6O
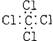
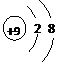
C.F原子结构示意图: D.四氯化碳的电子式:
2.在元素周期表中,同周期元素原子具有相同的( )
A.最外层电子数 B.核电荷数 C.电子层数 D.核外电子数
一、选择题
1.下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 放热反应在常温下一定很容易发生
C. 反应是放热还是吸热,可根据反应物和生成物所具有的总能量的相对大小判断
D.吸热反应在常温下一定不能发生
四、计算题:
29.(7分)某固定容积的2L密闭容器中进行反应 : N2+3H2 2NH3 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
2NH3 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
⑴.这5分钟内用N2来表示该反应的反应速率(请写出计算过程)。
⑵.平衡时H2的物质的量浓度: ;平衡时容器的压强为初始时的
(填“几分之几”)。
三、实验题:
28.(14分)某实验小组用下列装置进行乙醇催化氧化的实验。
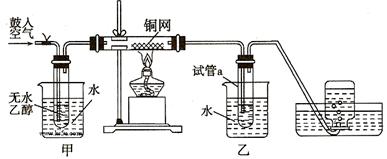
⑴.实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式
, 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是
反应(填“放热”或“吸热”)。
⑵.甲和乙两个水浴作用不相同,甲的作用是 ;乙的作用是 。
⑶.反应进行一段时间后,试管a中能收集到不同的物质,它们是 。集气瓶中收集到的气体的主要成分是 。
⑷.若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
(填写字母)。
a.乙酸 b.苯 c.乙醇 d.乙醛
三、推断题:
26.(10分)现有6种短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
W |
周期表中原子半径最小的元素 |
|
U |
地壳中含量最多的金属元素 |
|
R |
单质占空气体积的1/5 |
|
T |
M层上有6个电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z代表的元素时,用相应的元素符号表示):
⑴.元素T的原子核外共有________个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是__________。
⑵.用离子方程式表示:
①.元素Y与元素W形成的离子YW与NaOH溶液共热
。
②.元素U的单质与NaOH溶液反应:_______________________________________。
⑶.元素Z与元素T相比,非金属性较强的是________,下列表述中能证明这一事实的是________(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
⑷.探寻物质的性质差异是学习的重要方法之一。在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是________(用分子式表示),理由是________________________________________________________________________。
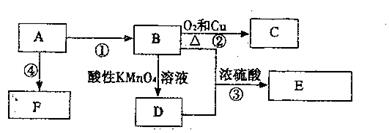 27.(10分)已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
27.(10分)已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
(1)A的电子式为 ,F的结构简式 。
(2)D分子中的官能团名称是 ,请设计一种实验来验证D物质存在该官能团的方法是
。
(3)写出下列反应的化学方程式并指出反应类型:
③ ,反应类型 。
二、填空题:
25.(11分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
⑴.上述实验中发生反应的化学方程式有 、
;
⑵.硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了Cu/Zn原电池,该原电池的电极反应式,负极: ;正极:
。
⑶.要加快上述实验中气体产生的速率,还可采取的措施有
(答两种)。
⑷.为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
|
实验 混合溶液 |
A |
B |
C |
D |
E |
F |
|
4mol·L-1 H2SO4/mL-1 |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL-1 |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL-1 |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①.请完成此实验设计,其中:V1= ,V6= ,V9= ;
②.该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
。
24.下列除去杂质的方法正确的是 ( )
① 除去乙烷中少量的乙烯——光照条件下通入Cl2
② 除去乙酸乙酯中少量的乙酸——饱和碳酸钠溶液
③ 除去CH4中少量的C2H4——酸性高锰酸钾溶液
④ 除去乙醇中少量的水——加足量生石灰,蒸馏
A.①② B.②④ C.③④ D.②③
第Ⅱ卷(非选择题 共52分)
23.同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的 ( )
A.质量 B.原子总数 C.碳原子数 D.密度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com