
6. 如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )。
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )。
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④
C.③④ D.②③
5.下列各物质具有正四面体结构的是( )。
①金刚石 ②二氧化碳 ③甲烷 ④四氯化碳
A.①②③ B.①③④
C.③④ D.全部
4.已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和直线型分子 M。(组成E分子的元素的原子序数小于10,组成G分子的元素为第三周期的元素。)如下图,则下列判断中正确的是( )。

(E) (G) (L) (M)
A.常温常压下,L是一种液态有机物
B.E是一种含有非极性键的分子
C.干燥的G 能漂白有色物质
D.上述反应的类型是取代反应
3.把纯净的甲烷与氯气的混合气放在集气瓶中,用玻璃片盖好瓶口,放在光亮的地方一段时间后,下列说法中,不正确的是( )。
A.气体发生爆炸反应
B.瓶内气体的颜色变浅
C.用一根蘸有浓氨水的玻璃棒伸入瓶内时有白烟产生
D.集气瓶壁有油状液体生成
2.等物质的量的下列有机物完全燃烧,生成CO2的量最多的是( )。
A.CH4 B.C2H6 C.C3H6 D.C6H6
一、选择题
1.在光照条件下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是( )。
A.CH3Cl B.CH2Cl2 C.CCl4 D.HCl
33.I.某化学兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
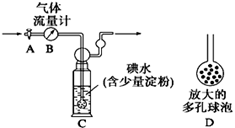
⑴洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_____
______________________________。
⑵洗气瓶C中发生反应的离子方程式 。
⑶洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”)。
II.实验室常用Na2SO3固体与浓硫酸反应制取SO2。
⑷现已制得SO2的饱和溶液,请利用此溶液(其他试剂任选),设计一个简单实验,比较SO2与Fe2+还原性的强弱(要求:写出实验步骤、现象和结论)
 。
。
⑸某研究小组测定部分变质的Na2SO3固体样品中Na2SO3的含量:
①取a克Na2SO3固体样品配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,0.0100mol/L碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
②计算:样品中亚硫酸钠的质量分数为 。
32.(16分)工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
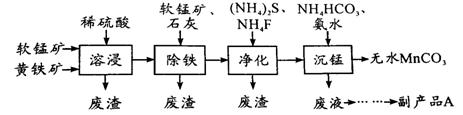
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是(用离子方程式表示) 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
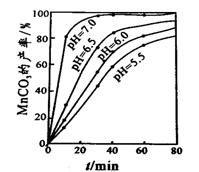 (4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如右图所示。根据图中信息得出的结论是 。
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如右图所示。根据图中信息得出的结论是 。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是___________ 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是
,沉锰工序中怎样证明MnCO3已经洗涤干净
,副产品A的化学式是 。
31.(16分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)
(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
|
物质 |
CH4 |
CO2 |
CO |
H2 |
|
体积分数 |
0.1 |
0.1 |
0.4 |
 0.4 0.4 |
①此温度下该反应的平衡常数K= 。
②已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1
II.CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 
III.2CO(g)+O2(g)=2CO2(g) △H3
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= (用△H1 △H2 △H3表示)。
2CO(g)+2H2(g) 的△H= (用△H1 △H2 △H3表示)。
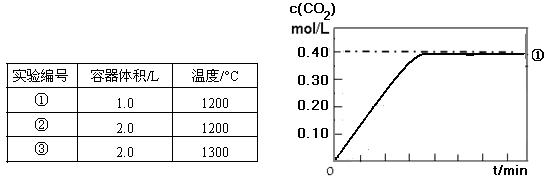
③对上述反应II:CO(g) +
H2O(g)  CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO 和 1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副 反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO 和 1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副 反应的影响)。实验条件如下表:
①实验中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,分别画 出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
 (2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生 成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
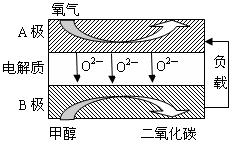 (3)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
(3)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
①B极的电极反应式为 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole— 时,实际上消耗的甲醇的质量比理论上大,可能原因是 。
30.(16分)碳酸二甲酯 (DMC)是一种新型的绿色有机合成中间体,其在生产中具有使用安全、方便、污染少、容易运输等特点。已知一定条件下,碳酸二甲酯能发生如下反应:
(DMC)是一种新型的绿色有机合成中间体,其在生产中具有使用安全、方便、污染少、容易运输等特点。已知一定条件下,碳酸二甲酯能发生如下反应:
反应①: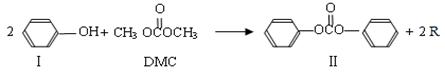
反应②: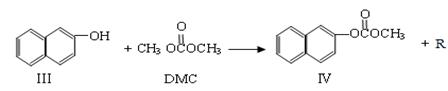
(1)化合物Ⅲ的分子式为  ,反应①和反应②中R的结构简式为 。
,反应①和反应②中R的结构简式为 。
(2) DMC与足量NaOH溶液反应的化学方程式 。
DMC与足量NaOH溶液反应的化学方程式 。
(3)类似于反应①,DMC与乙酸苯酯(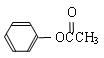 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是 。
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是 。
A.G的名称是甲酸乙酯
B.丙酸和G互为同分异构体
C.一定条件下,G能发生水解反应
D.G能与新制Cu(OH)2反应生成红色沉淀
(4)反应①中反应物用量不同,可得到化合物H(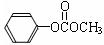 ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体
。
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体
。
A.遇FeCl3溶液显紫色,B.苯环上的核磁共振氢谱有两组峰,C.能发生银镜反应
(5)以碳酸二甲酯合成杀虫剂西维因的路线如下:
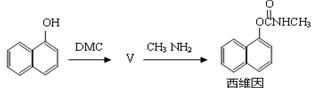
其中生成物Ⅴ的反应类似于反应②,则Ⅴ的结构简式为 ,1mol西维因最多可与 mol H2发生加成反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com