
5、在科学史上,中国有许多重大发明,为世界现代物质文明奠定了基础,以上发明属于化学史上中国对世界的重大贡献的是………………………………………( )
①造纸 ②印刷技术 ③火药和中药学 ④指南针 ⑤炼铜、炼铁、炼钢 ⑥陶瓷 ⑦合成有机高分子材料 ⑧首次人工合成蛋白质
(A)①②③④⑥ (B)①③⑤⑥⑦ (C)①③⑤⑦⑧ (D)①③⑤⑥⑧
4、下列四种变化中,与其它三种变化有本质区别的一种是………………………( )
(A)硝酸钾受热熔化 (B)浓盐酸敞口放置空气中形成白雾
(C)海水晒盐 (D)氢氧化钠固体暴露在空气中质量增加
3、要配平的化学方程式:C2H2+O2 H2O+CO2,各分子式前的系数(化学计量数)之和为( )
(A)10 (B)15 (C)13 (D)18
2、将地壳中含量较多的四种元素按从多到少的顺序排列,正确的是……………( )
(A)Si、O、Al、Fe (B)O、Si、Al、Fe (C)Al、Fe、O、Si (D)Si、Al、O、Fe
1、化学成为一门科学开始于……………………………………………( )
(A)对燃烧现象的深入研究 (B)对空气组成的研究
(C)用原子-分子论来研究化学反应之后(D)英国科学家汤姆生发现电子之后
试计算X中Na2CO3与NaHCO3的质量分数各是多少?
30.出土木制文物常处于水饱和状态,出土后若任其自然干燥将收缩、变形。一种保持文物原状的方法是:将95份(质量)K2SO4·Al2(SO4)3·24H2O(明矾)和5份H2O混合加热到90℃制成饱和溶液,并继续加热到92℃~95℃,将木制文物浸渍其中。待明矾充分渗入,使明矾溶液取代木材中的水分后,趁热将文物从明矾溶液中取出,冷却至室温。明矾在文物中结晶,再在文物外部涂一层亚麻油。求90℃时明矾的溶解度(回答大于某值即可,但要写出计算过程。已知明矾溶解度随着温度升高而显著变化)。
22.许多在水溶液中的反应(如复分解反应),往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象,下表为相同温度下某些物质的溶解度。
⑴若在有氯化银固体的水中加入硫化钠溶液,可能发生的现象是__________________________;⑵生产硫酸铵化肥的方法之一是:把石膏粉(CaSO4)悬浮于水中,不断通入氨气并再通入二氧化碳,充分反应后,立即过滤,滤液经蒸发而得到硫酸铵晶体。写出该反应的化学方程式_____________________________。 23.已知海水含有氯化镁,但因其含量低而不能用于生产镁。某工厂利用海水和海边丰富的贝壳(主要成分是CaCO3)资源来制取氢氧化镁,然后制取较纯净的氯化镁,并再用于生产镁。写出制取氯化镁的有关反应的化学方程式________________________________________________。 24.河水里的微生物使有机物(以C6H10O5表示)转化为CO2和H2O的过程中所需的O2量叫生化需氧量(BOD),BOD是衡量水体质量的一个指标。⑴C6H10O5和O2反应生成CO2和H2O的化学方程式为________________________;⑵20℃时,1.0升某水体(假使该水的密度为1克/毫升)中含有机物C6H10O5的质量分数为0.0010%,则该水体的BOD为_____克/升;⑶20℃时,1.0升水中溶0.0092克O2,上述水体适合于鱼类生存吗?______,原因是____________________ 三、实验题(共24分) 25.欲确定某碳酸钠样品(含有少量硫酸钠)中其碳酸钠的质量分数,可进行如下实验:称取样品a克,加水溶解,在该溶液中加入过量的盐酸使溶液呈酸性,再加入过量氯化钡溶液,过滤、洗涤沉淀,并将沉淀烘干,称量沉淀为b克。请回答:⑴溶液用盐酸酸化的原因是______________________;⑵需要加入过量氯化钡溶液的原因是____________________;⑶检验氯化钡是否加入过量的方法是___________________;⑷计算样品中含Na2CO3质量分数的表达式是_______________. 26.利用下列图示连接装置,进行氢气还原氧化铜的实验,并测定铜的相对原子质量(已知H、O的相对原子质量),试回答:
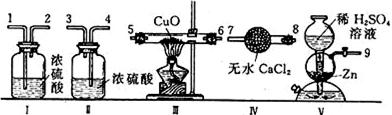
⑴仪器装置的连接顺序(填写接口代码数字): ( )接( ),( )接( ),( )接( ),( )接( );
⑵装置Ⅰ、Ⅱ的作用分别是_____________________________________________________;
⑶加热CuO之前必须进行的操作是______________________________________________。 27.化学实验室有含Hg2+、Fe3+、Cu2+等金属离子的废液,甲、乙两位同学设计从废液中回收金属汞和铜的实验方案如下:
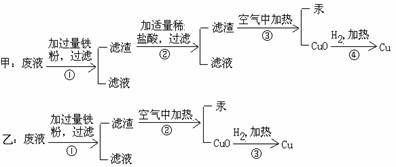
试回答:⑴上述两个实验方案中能达到回收目的的是哪个方案?_______;在该方案操作的第①步得到的滤渣中含有_________金属;⑵操作的第③步可分离__________;⑶汞蒸气有毒,回收汞时,为防止汞蒸气扩散污染环境,该步操作应在(选择下列有关序号填写)_________中进行。 A.冷而干的烧杯 B.瓶口塞有直接玻璃管的锥形瓶 C.管口塞有导管的大试管,且导管一端插入水槽中(水封) D.密闭的并有冷却功能的仪器装置 28.由实验测知:取3.5克KMnO4,晶体加热到220℃,分解放出的氧气多于按下式计算的理论量。按下式计算的理论量为放出0.354克氧气, 2KMnO4 △ K2MnO4 + MnO2 + O2↑
(溶于水呈紫红色)(溶于水呈绿色) (黑色不溶) 换算成标准状况下的体积为248毫升,而实际测得的氧气为308毫升(标准状况),超过理论量为:308毫升-248毫升=60毫升。
试回答:⑴怎样用实验证明:超理论量的氧气不是来自MnO2?
⑵怎样用实验证明超理论量的氧气是由K2MnO4分解产生的?(要求用KMnO4制取氧气后的残渣实验,如右图所示)
⑶怎样从“最后残渣”中分离出MnO2?
21.有X、Y、Z三种元素,它们的原子核内质子数均不超过18,它们能相互形成XZ和YZ型化合物,X2+和氖原子的核外电子排布相同;Y原子和X2+的电子层数相同,但比Z原子少2个电子,Y原子的最外层电子数是次外层的2倍。
试求:⑴X、Y、Z原子核的质子数____,____,____;
⑵若X、Y、Z的原子核内的质子数与中子数均相等,则化合物XYZ3的式量是 。
C.O2与O3是不同的物质 D.O2与O3的性质完全相同 4.大气层中因CO2含量不断增加而引起“温室效应”,造成大气中CO2含量增加的主要原因是( ) A.由于动植物呼吸作用增加 B.由实验室逸出的CO2增加 C.由于森林绿化面积迅速递减,使得自然界吸收CO2的能力降低 D.由于大量燃烧矿物燃料 5.有CuO、Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液和稀硫酸七种物质,在常温下两种物质间能发生的化学反应最多有( ) A.4个 B.5个 C.6个 D.7个 6.在氯化亚铁和氯化铜的混合溶液中加入锌粉,下列说法中不正确的是( ) A.若反应完成后锌有剩余,则溶液中有Zn2+,无Cu2+,可能有Fe2+ B.若反应完成后锌有剩余,则溶液中有Zn2+,没有Cu2+和Fe2+ C.若反应完成后锌无剩余,溶液中若有Cu2+,则一定有Fe2+ D.若反应完成后锌无剩余,溶液中若无Cu2+,则可能有Zn2+和Fe2+ 7.两种化合物AB和DB2,若A元素的化合价与H2O中O的化合价绝对值相同,则D的化合价为( ) A.+4 B.+2 C.-2 D.-3 8.测得某溶液中含Cu2+、K+、SO42-、Cl-四种离子,且阳离子的个数比为Cu2+:K+=3:4,则SO42-与Cl-的个数比可能是( ) A.3∶2 B.1∶3 C.1∶8 D.2∶5 9.由C、H两种元素组成的化合物叫烃,碳原子数在4及其以下的烃在常温常压下为气体,常温常压时烃C2H4和另一种烃组成的混合气体中碳元素的质量分数为87%,则混入的烃可能是( ) A.CH4 B.C2H2 C.C2H8 D.C8H8 10.室温时,将硝酸钠和氯化钾两种饱和溶液混合后无晶体析出,加热蒸发时,开始析出的晶体是( ) A.KNO3 B.KCl C.NaNO3 D.NaCl 11.在t℃时,100克水中加入m克Na2CO3或加入n克Na2CO3.10H2O,均可使溶液达到饱和,则m和n的关系式正确的是( )
|
A.m= |
106n |
B.m= |
1060n |
C.m= |
1060n |
D.m= |
1060n |
|
|
286 |
|
2860+18n |
|
2860+10.6n |
|
2860+28.6n |
12.某学生的实验报告中有以下实验数据,其中正确的是( ) A.用托盘天平称取11.70克食盐 B.用量筒量取5.29毫升盐酸 C.用广泛pH试纸测得溶液的pH值是5.4 D.用托盘天平称取2.5克锌 13.某学生用量筒量取液体,将量筒平放且面对刻度平视测量。初次视线与量筒内凹液面的最低处保持水平,读数为20毫升,倒出部分液体后,俯视凹液面的最低处,读数为5毫升,则该学生实际倒出液体的体积是( ) A.大于15毫升 B.小于15毫升 C.等于15毫升 D.无法确定 14.对于化学反应A+B=C+D,下列说法中错误的是( ) A.若生成物C和D分别是盐和水,则反应物一定是酸和碱 B.若A和C是单质,B和D是化合物,则该反应一定是置换反应 C.若A是可溶性碱,B是可溶性盐,则C、D可能是两种沉淀 D.若A、B各取10克混合,使其充分反应,则C、D质量的总和一定等于20克 15. 1.6克某物质在氧气中完全燃烧生成4.4克二氧化碳和3.6克水,关于该物质的组成有下列论断:①一定含C、H;②一定不含O;③可能含O;④一定含O;⑤分子中C、H的原子个数比为1:2;⑥分子中C、H的原子个数比为1:4,其中正确的是( ) A ①②⑥ B ①②⑤ C ①③⑥ D ①④⑤ 二、填空题(共34分) 16.汽车尾气中含有CO和NO等有毒气体,其净化过程如下:⑴在催化剂催化作用下,CO将NO还原成N2;⑵再通入过量空气,使剩余的CO完全氧化。试写出有关反应的化学方程式:⑴ ;⑵ 。 17.为鉴定氯酸钾中含有氯元素,给定的试剂和实验操作有:①滴加AgNO3;②冷却后,加水溶解;③加热;④滴加稀硝酸;⑤过滤后取滤液;⑥加催化剂二氧化锰。按实验操作的先后,其顺序正确的是(填号) 。 18.有些牙膏中添加有少量的氟化物如氟化钠(NaF)等,写出氟化钠溶于水的电离方程式______________________,刷牙时氟化钠跟牙齿矿物质~羟磷石[Ca10(PO4)6(OH)2]反应生成氟磷灰石[Ca10(PO4)6F2],氟磷灰石具有更能抗酸(牙缝中食物残渣发酵生成的有机酸)的作用,从而达到防治龋齿的目的。写出生成氟磷灰石反应的化学方程式_________________________。 19.欲防止煤燃烧产生的SO2污染大气,有多种化学方法,例如:⑴在煤中掺消石灰:煤燃烧时,SO2与消石灰反应生成CaSO3再被氧化成CaSO4,写出反应的化学方程式__________________;⑵回收利用:将工厂燃煤废气中的SO2通入石灰乳中,可生成Ca(HSO3)2,它可用于造纸浆等。
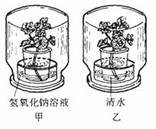
写出反应的化学方程式_________________________________。 20.证明“光合作用需要二氧化碳的实验”可利用右图所示的甲(玻璃缸中盛NaOH溶液)、乙(玻璃缸中盛清水)两个装置,将这两个装置同时放在黑暗处一昼夜,然后一起放到阳光下,几小时后,检验甲装置中植物的叶片没有新的淀粉生成,而乙装置中植物的叶片却有新的淀粉生成。其原因是甲装置里的CO2 ,反应的化学方程式是 。
19.(5分)将一定量的石灰石放入烧杯中,加入100 g稀盐酸恰好完全反应(杂质不 溶解,也不参加反应),此时,烧杯中物质的总质量比反应前减少了8.8 g。
试计算:
(1)石灰石中碳酸钙的质量;
(2)所用盐酸溶质的质量分数。(计算结果精确到0.1%)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com