
请将正确答案的字母代号填在上面的答案栏中。)
1.元素周期表是学习化学的重要工具,下图是元素周期表中的一格,下面从该图获取的信息中,正确的是( )
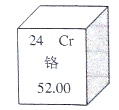
A.该元素的原子序数为52
B.该元素属于非金属元素
C.该元素在地壳中的含量为52.00%
D.该元素的原子核外有24个电子
24.(8分)我市北临渤海湾,是全国重要的产盐区。下图是某盐场生产并处理过的工业盐产品质量指标。某学习小组为了测定该工业盐中氯化钠的质量分数,进行如下实验:①取100g该工业盐加热烘干,测得水的质量为3.36g;②另取l00g该工业盐溶于水中加入足量碳酸钠溶液得到碳酸钡沉淀1.97g(反应的化学方程式为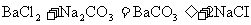 l)。求:
l)。求:
(1)100g该工业盐中含氯化钡的质量;
(2)通过计算,判断该工业盐中氯化钠的质量分数是否符合产品质量指标。(计算结果保留2位小数)

23.(10分)含镁3%-5%的镁铝合金是轮船制造、化工生产、机械制造等行业的重要原材料。现有一块质量为w g的镁铝合金,某研究性学习小组欲测定其中镁的质量分数。
[查阅资料]已知铝与NaOH溶液反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2,化学方程式为: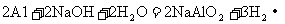 ;镁不与NaOH溶液反应。氢氧化铝能与氢氧化钠溶液发生反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2O,化学方程式为:
;镁不与NaOH溶液反应。氢氧化铝能与氢氧化钠溶液发生反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2O,化学方程式为: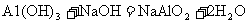 ;氢氧化镁不与氢氧化钠溶液反应。
;氢氧化镁不与氢氧化钠溶液反应。
[提出猜想]利用镁铝与酸、铝与碱、氢氧化铝与碱反应的化学性质来测定合金中镁的质量分数。
[设计方案]研究小组设计了不同的实验方案。
方案l:镁铝合金与过量盐酸反应测定生成气体在标准状况下的体积为V1L;
方案2:镁铝合金与过量NaOH溶液充分反应后,过滤、洗涤、干燥、称量剩余固体的质量为w1g;
方案3:镁铝合金与过量盐酸溶液反应后再与过量NaOH溶液反应,过滤、洗涤、干燥、称量沉淀的质量为w2g。
[问题讨论]请你参与研究小组的研究过程,并回答有关问题:
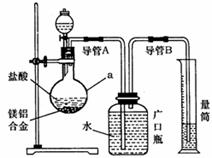
(1)研究小组利用上图所示实验装置,按照方案1进行了实验。
①装置中仪器a的名称是 。
②实验装置中有一处明显错误,请指出
(2)方案2中剩余固体是 ;若按方案2进行实验,测得镁的质量分数为 。
(3)方案3中“过滤”得到的沉淀是 。
(4)某同学又设计了与上述方案原理不同的方案4,也能测得镁的质量分数。请你在横线上填写合适的内容,将该方案补充完整。
方案4:镁铝合金与 反应测定生成气体在标准状况下的体积为V2L。
[方案评价]
(5)在实验方案1-4中,你认为最佳的实验方案是 。
22.(8分)山东省海域辽阔,盛产海带,海带中含有丰富的碘。为了从海带中提取碘,某研究小组设计并进行了以下实验:
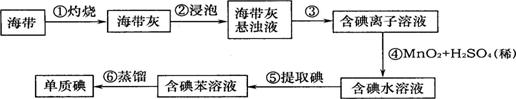
请你填写下列空白:
(1)步骤①灼烧海带时,除需要坩埚、泥三角、三角架外,还需要用到的一种仪器是
(填写序号)。
A.烧杯 B.酒精灯 C.研钵 D.干燥器
(2)步骤②浸泡中,使用了玻璃棒,其作用是 。
(3)步骤③的实验操作名称是 ,该操作中除用到铁架台、烧杯、滤纸外,还用到的仪器是 、 。
(4)实验中用到托盘天平,在使用时,先 ,然后把称量物放在 盘,要用 夹取砝码放在另一盘中。
21.(8分)已知A、B、C、D、E、F、I、X是初中化学中常见的物质,其中A、B含有相同的元素,B、D、E、X为氧化物,F是最简单的有机物,C、I为单质。
它们相互转化的关系如右下图所示(图中反应条件已略去)。请回答:
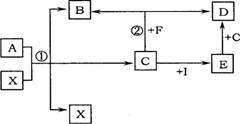
(1)X在反应①中起的作用是 。
(2)A的化学式是 。
(3)写出反应②的化学方程式
。
(4)实验室检验气体D的方法是 。
20.(6分)某学习探究小组用水电解器电解水,测定两管逸出气体的体积,记录如下:
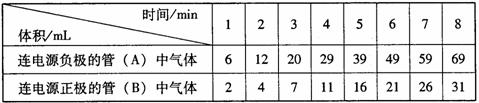
请回答:
(1)写出电解水的化学方程式 。
(2)装置密闭性良好、读数正确,但电解开始阶段两管气体的体积比不符合理论比值的原因是 。
(3)自第 分钟起管(A)和管(B)产生气体的体积比非常接近理论比值。
19.(6分)甲、乙是常见元素的单质,A、B是常见的化合物,它们的反应:甲+A→B+乙(式中各物质的化学计量数和反应条件已略去)。请回答:
(1)反应类型是 。
(2)若甲、乙为金属,且乙的硫酸盐溶液为蓝色,写出反应的化学方程式 。
(3)若乙为非金属单质,B中含有+3价金属元素,写出反应的化学方程式 。
18.(8分)随着科学的进步,化学与人类健康的关系越来越密切。食品保鲜可以防止食品腐坏,保持食品的营养和味道。食品保鲜的措施有添加防腐剂、充填气体、放干燥剂和脱氧剂等。
(1)包装熟食品时,常加防腐剂苯甲酸钠(C7H502Na),它含有 种元素,其相对分子质量为 。
(2)小包装糕点类食品常采用充气包装。氮气是常用的充填气体,请你根据氮气的性质说明选用氮气的主要原因 。
(3)生石灰是常用的干燥剂,它属于 (填序号)。
A.酸 8.碱 C.盐 D.氧化物
写出生石灰与H2O反应的化学方程式并指出反应类型
(4)某脱氧剂的主要成分为活性铁粉,利用铁与氧气、水反应生成氢氧化铁,来吸收包装袋中氧气和水蒸气,从而延长食品的保质期,写出反应的化学方程式 。
17.某研究性小组设计了下表中的三组实验,分别向甲物质中逐滴加入相应的乙溶液至过量。
|
|
① |
② |
③ |
|
田 |
铜、锌的混合物 |
硫酸和硫酸铜的混合溶液 |
盐酸和氯化铵的浓溶液 |
|
乙 |
稀硫酸 |
氢氧化钠溶液 |
氢氧化钠浓溶液 |
反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用右图所示曲线表示的是
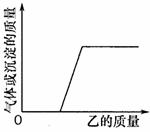
A.①② B.①③ C.②③ D.①②③
第Ⅱ卷 (非选择题 共54分)
16.按照一定依据把物质进行分类,是研究物质的组成、结构、性质和用途的常用方法。现有三组物质:①金刚石、水银、镁条、干冰;②醋酸、小苏打、食盐、纯碱;③白酒、空气、盐酸、白磷。每组中均有一种物质所属类别与其他三种不同,这三种物质依次是
A.金刚石、小苏打、白酒 B.干冰、醋酸、白磷
C.水银、食盐、空气 D.镁条、纯碱、盐酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com