
4.甲乙两种物质的溶解度曲线如图所示,下列叙述中,不正确的是 ( )
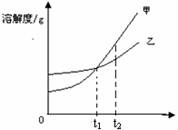
A.甲、乙两种物质的溶解度都随温度升高而增大
B.t1℃时,甲物质的溶解度等于乙物质的溶解度
C.t2℃时,甲物质的溶解度大于乙物质的溶解度
D.t2℃时,甲、乙饱和溶液中溶质的质量分数相等
3.室温下,只各盛有100ml水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示,下列说法正确的是 ( )
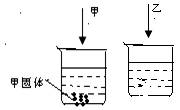
A.甲溶液是不饱和溶液
B.常温下,甲、乙两种物质的溶解度相同
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能是饱和溶液,也可能是不饱和溶液
2.溶液析出晶体后,其剩余溶液是 ( )
A.饱和溶液 B.不饱和溶液 C.只有溶剂 D.稀溶液
1.下列材料属于合金的是 ( )
A.纯硅 B.青铜器 C.青花瓷器 D.汉白玉雕塑
23.(6分)将铜和氧化铜固体混合物粉末11.2g放入烧杯中,当加入稀硫酸100g时,氧化铜与硫酸恰好完全反应,过滤后所得溶液的质量为108g(不考虑过滤过程中溶液的质量损失)。
(1)混合物中铜元素的质量分数为______________(计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数,写出计算过程。
22.(8分)实验盒中有7种没有标签的溶液,老师让化学实验小组同学鉴别这些溶液。

(1)调查研究:
①实验盒中记录单上登记的7种溶液是:KMnO4、Na2CO3、CuSO4、NaCl、
Ca(OH)2、NaOH和稀盐酸,其中有颜色的是_______________________溶液。
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸。
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液可能是Na2CO3、NaCl、Ca(OH)2和稀盐酸。
(3)实验探究:同学们按以下步骤进行鉴别。
第一步:取4支试管,分别加入少量的A、B、C、D溶液。然后依次加入少量盐酸,实验现象记录如下:
|
溶液 |
A |
B |
C |
D |
|
加入盐酸后的现象 |
无明显变化 |
无明显变化 |
有气泡产生 |
无明显变化 |
实验结论:C是___________溶液。
第二步:依据下图装置进行实验,其中夹持固定装置已略去。从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化。
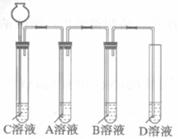
实验解释:A溶液中发生反应的化学方程式为___________________________。
第三步:依据下图装置进行2个实验。取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热。再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热。

实验结论:B是稀盐酸。D是NaCl溶液.
经过上述三步实验.同学们认为第5种无色溶液是NaOH溶液.
(4)实验反思:老师引导同学们讨论了上述实验探究过程,进行了全面反思。
①老师指出:实验结论仍有不确定性。不能确定的是_____________溶液:其鉴别方法是____________________________________________________________________________
_____________________________________________________________________________。
②老师提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液。请完成下列实验报告。
|
实验步骤 |
实验现象和结论 |
|
|
|
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:
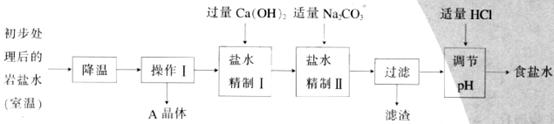
(3)“降温”的目的是析出副产品“A晶体”,A的化学式是______________;
(4) “操作I”中的操作是_____________,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有_______________________________;
(5) “盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是:
__________________________________________________________________________;
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是:
_________________________________________________________________________。
(一)原料岩盐水主要是含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁。上述几种物质在不同温度时的溶解度数据如下表:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
|
溶 解 度 /g |
氯化钠 |
35.7 |
35
8 |
36.0 |
36.3 |
36.6 |
|
硫酸钠 |
4.5 |
9.6 |
20.2 |
40.8 |
48.4 |
|
|
氯化钙 |
59.5 |
65.0 |
74.5 |
100 |
116 |
|
|
氯化镁 |
52.9 |
53.8 |
54.8 |
56.0 |
58.0 |
(1)根据所提供的溶解度数据,画出硫酸钠的溶解度曲线:
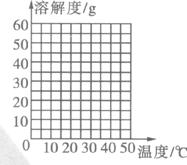
(1)10℃时由100g水配制得到得饱和硫酸钠溶液中溶质得质量分数是____________(精确到0.1%);
18.(4分)下图所示是家庭中常用的几种灭火方法,请将相应方法的灭火原理填在表中对应的空白处。

19.(5分)某课外活动小组的同学利用下列装置探究CO2的实验室制法。
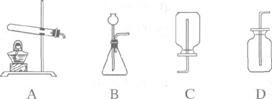
(1)甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是_________,收集装置是_____________。发生反应的化学方程式为_____________________________;
(2)加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是_____________,他不选择加热碳酸氢铵制取CO2的理由是_______________________________________。
20.(6分)某同学在自主学习酸的知识时,设计了以下实验报告,请将该实验报告补充完整。
[实验目的]_______________________________________________________________。
[实验用品]试管、铁片、铜片、稀盐酸、稀H2SO4、NaOH溶液、石蕊和酚酞试液等。
[实验内容]
|
实验步骤 |
(1) 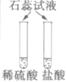 |
(2)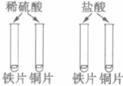 |
(3) 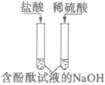 |
|
实验现象 |
溶液变为________色 |
稀硫酸中的Fe片表面都有________产生,Cu片表面都没有明显现象 |
溶液由红色变为无色 |
|
分析与 结论 |
结论:稀酸能与指示剂作用 |
铁与稀硫酸反应的化学方程式为_____________________________ 结论:稀酸能与较活泼金属反应 |
结论: 酸能_______________ |
[实验思考]从物质组成的角度解释酸具有通性的原因__________________________。
21.(7分)某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品。
17.3月22日是“世界水日”,2008年“世界水日”的主题是“涉水卫生”。
(1)地球表面约有71%被水覆盖,但可供人类使用的淡水总量却不足总水量的1%。保护水环境、珍爱水资源,是每个公民应尽的责任和义务。下列做法会造成水体污染的有_________________(填序号)。
A.工业废水直接排放 B.工业废水处理后排放
C.禁止使用含磷洗衣粉 D.大量使用化肥、农药
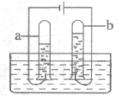
(2)下图是通电分解水的实验装置。在实验过程中,试管a中产生的气体是______;
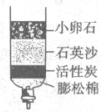
(3)为除去水中的不溶性杂质,某同学制作了如下图所示的简易净水器,其中活性炭的主要作用是______________________________________________________;
(4)自来水中含有少量的Ca(HCO3)2等可溶性盐。烧水时,Ca(HCO3)2发生分解反应,生成难溶性的CaCO3是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式:______________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com