
3.下列实验操作中,正确的是
A.向燃着的酒精灯里添加酒精 B.将实验剩余的药品放回原试剂瓶
C.加热后的试管立即用水清洗 D.点燃镁条前,在桌子上预放石棉网
2.下列实验项目与所选择的仪器无关的是
A.较多量液体加热--量筒
B.吸取和滴加少量液体--胶头滴管
C.蒸发液体--蒸发皿
D.称取一定质量的固体粉末--托盘天平
1.下列是日常生活中的一些变化,其中属于化学变化的是
A.黄豆磨成豆浆 B.在-218℃,氧气变成液态氧
C.氢氧化钠溶于水放热 D.二氧化碳通入澄清石灰水变浑浊
25.(8分)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如下图所示。试计算:
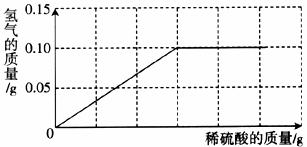
(1)样品中铜的质量分数。
(2)反应所消耗的硫酸溶液质量。
(3)反应后所得溶液中溶质的质量分数。
24.(6分)肾病患者需要食用低钠盐的食品,目前市场供应的低钠盐多为苹果酸钠盐(C4H5O5Na)。请回答:
(1)苹果酸钠盐中各元素的质量比为C︰H︰O︰Na=__________,苹果酸钠盐中钠元素的质量分数为__________。
(2)15.6g苹果酸钠盐中的钠元素质量与__________g食盐中的钠元素质量相等。
23.(10分)松花皮蛋是我们喜爱的食品之一。某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等。同学们对料泥进行了如下探究:
[猜想]猜想Ⅰ:料泥的主要成分是Ca(OH)2、NaOH、KOH、CaCO3、灰份;
猜想Ⅱ:料泥的主要成分是NaOH、KOH、Na2CO3、CaCO3、灰份。
[实验与现象]实验过程与现象如下图:
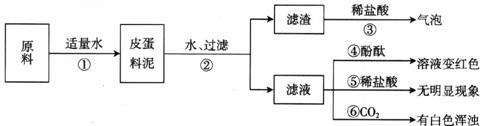
[问题与讨论]
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、__________,玻璃棒在步骤②中的一种作用是______________________________。
(2)步骤③的现象说明滤渣中含有:__________(写化学式)。
(3)请写出步骤①发生的任意两个反应的化学方程式:_________________________。
(4)由上述实验现象推断,猜想_________是正确的,其理由是___________________。
22.(13分)利用下列仪器进行气体的制取和性质实验,完成下列问题。
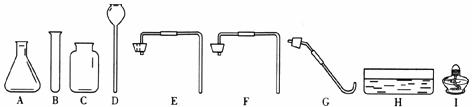
(1)仪器B、I的名称分别是__________、__________。
(2)实验室用高锰酸钾制取氧气,仪器的装置组合是__________(填字母),反应的化学方程式为______________________________。
(3)实验室制取二氧化碳,所用的药品是__________,从上述仪器中组合三套发生装置为__________、__________、__________(填字母),检验二氧化碳收集满的方法是______________________________。
(4)在B中收集满二氧化碳,倒扣于盛有水的H中,一段时间后,B中液面________(填“上升”或“不变”);若B中充满下列__________气体,也会发生类似现象。
A.H2 B.NO2 C.HCl D.CO
(提示:①3NO2+H2O=2HNO3+NO,NO气体难溶于水;②同温同压下,任何气体体积之比等于分子数之比。)
21.(7分)近几年我省部分地区铅锌矿、锰矿的开采和冶炼工业发展很快。为响应广州政府“落实科学发展观,加强生态省建设”的号召,某中学环保自愿小组决定对当地一座冶炼厂排放的废水进行检验.经了解该厂称本厂产生的废水含有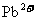 (铅)、
(铅)、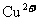 和较强的酸性,排出前已在处理池中使用NaOH、Na2CO3等进行了处理,经沉淀后排放出的废水已不含重金属离子且近中性。经查资料:
和较强的酸性,排出前已在处理池中使用NaOH、Na2CO3等进行了处理,经沉淀后排放出的废水已不含重金属离子且近中性。经查资料: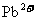 、
、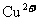 与Na2S反应会生成黑色沉淀。请你参与帮助他们完成下表所示的检测活动:
与Na2S反应会生成黑色沉淀。请你参与帮助他们完成下表所示的检测活动:
|
检测目的 |
实验步骤及现象 |
实验结论 |
|
(1)检测是否 有 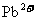 、 、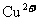 |
取排出废水样品,观察为澄清无色。滴加Na2S溶液,无明显现象。 |
废水中不含__________ |
|
(2)测酸碱度 |
|
废水pH=13呈较强碱性 |
|
|
||
|
|
||
(3)检测是否含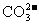 |
|
废水中含有较多的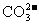 |
|
|
||
|
|
据以上信息,你对该厂领导提出的建议是______________________________。
20.(8分)归纳整理物质间相互反应规律是重要的学习方法。如下图中连线两端的物质均能发生反应,其中甲、乙、丙、丁分别是Zn、BaCl2溶液、Na2CO3溶液和盐酸中的某一种。
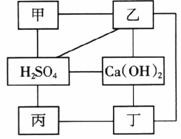
(1)试判断:乙是__________,丙是__________。
(2)请你完成下列反应的化学方程式,并指出其基本反应类型。
Ca(OH)2+乙:____________________,属于__________反应。
丙+丁:____________________,属于__________反应.
19.(4分)下列数据是硝酸钾固体在不同温度时的溶解度。
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
(1)硝酸钾溶液中的溶剂是__________。
(2)20℃时,向50g水中加入18g硝酸钾,充分溶解后得到__________(填“饱和”或“不饱和”)溶液。
(3)20℃时,有剩余硝酸钾固体的溶液中,若使硝酸钾完全溶解,可以采用的方法是______________________________。
(4)如下图所示,小烧杯中盛放的是上述(3)中所得的硝酸钾溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌一定能够使小烧杯中有固体析出的是__________(填字母)。
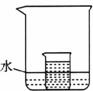
A.冰 B.浓硫酸 C.硝酸铵 D.干冰
E.氢氧化钠 F.氧化钙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com