
2.下列关于空气的说法正确的是
A.空气是一种化合物
B.空气中既有单质也有化合物
C.空气里含量最多的气体是氧气
D.细铁丝可以在空气中剧烈燃烧,火星四射,生成一种黑色固体
1.下列食品、调味品的制作过程中,没有发生化学变化的是

A.鲜奶制酸奶 B.黄豆酿酱油 C.糯米酿甜酒 D.水果榨果汁
35.(共3分)某合金的主要成分有锌、铜、碳等物质。为测定合金的某些含量做如下实验:向50.3 g合金粉末中逐次滴加等质量的质量分数为20.0 %的硫酸铜溶液(已知碳不参与反应),充分反应后,得到如下部分数据和图像。
|
次数 |
第1次 |
第2次 |
|
硫酸铜溶液的质量/g |
80.0 |
80.0 |
|
粉末的质量/g |
50.2 |
50.1 |
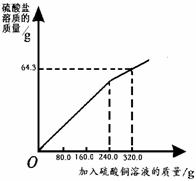
计算反应后:
(1)粉末减轻的质量.
(2)加入320.0 g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比。
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0 g)。
34.(共3分)汽车尾气排放出的气体主要有NO和NO2,它们污染环境。可用氨气(NH3)除去有害气体,该反应的化学方程式为2NH3 + NO + NO2 2N2+3H2O。若反应后得到2.8g的N2,理论上需要氨气的质量多少克?
2N2+3H2O。若反应后得到2.8g的N2,理论上需要氨气的质量多少克?
33.(共8分)浴室喷头长时间使用会有白色固体附着,这是因为硬水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙[Ca(HCO3)2]受热易分解,生成难溶性的化合物、气体等物质。某小组探究碳酸氢钙受热分解后产物的成分。
[提出猜想]从组成物质元素的角度分析:
猜想1.生成的难溶性化合物可能是 。
猜想2.放出的气体可能是O2、H2、CO2 。
[方案设计]请你设计实验,帮助该组同学确定难溶物的成分。
|
实验步骤 |
实验现象和结论 |
|
|
|
[实验探究]该组同学设计如下实验,继续探究气体的成分。
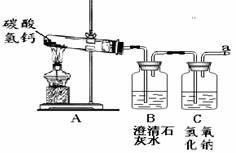
操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊。
操作2.在a处用燃着的木条检验,无明显现象。
[实验结论]
结论1.碳酸氢钙分解产生的气体一定有 ;一定没有 。
结论2.碳酸氢钙受热分解的化学方程式为Ca(HCO3)2 CaCO3
↓+ CO2↑
CaCO3
↓+ CO2↑
[实验交流]
交流1.从安全的角度考虑,操作2中存在的实验不足是 。
交流2.小组内某同学对上述结论提出异议:
|
该同学的观点 |
请说出你的观点并阐述理由 |
|
该实验没有对氧气进行验证 |
|
|
“结论2”不正确 |
|
32.(共6分)老师用下图所示装置为同学们做了一个实验。A装置中装有体积比约为3:1的空气和二氧化碳的混合气;B装置中盛有足量铁粉;C装置中盛有足量的稀硫酸。
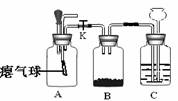
(1)关闭活塞K,当将A装置中胶头滴管里足量的氢氧化钠溶液挤入瓶中,可以观察到A装置中的现象是 ;A装置发生反应的化学方程式 。
(2) 立即打开活塞K,一段时间后,关闭活塞K。B装置中发生反应的化学方程式 ;在整个实验过程中,可以观察到C装置中的现象是 ; 。
(3)C装置的作用是 (填字母)。
a.提供药品 b.控制气体总量 c.调节装置内的压强 d.可用来储存气体
31.(共5分)根据下图所示,回答下面问题。
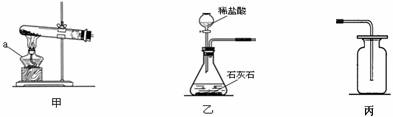
(1)写出a的名称 ,用装置甲制取氧气的化学方程式 。
(2)若利用乙和丙装置可以制备的气体是 。
(3)将甲中反应后的产物洗涤、过滤,得到黑色粉末。该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式____________,黑色粉末在该反应中的作用_ ____。
30.(共6分)A -G是初中化学常见的七种物质。“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系。(部分生成物和反应条件已略去)
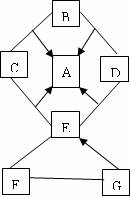
(1)若A、D 两物质的相对分子质量比为11:7,A、C、D 均含有一种相同元素,E、F、G间的反应均在常温下进行,B与G的反应属于化合反应。则B的化学式 ; G→E的反应条件是 ;
写出下列反应的化学方程式:
①D+ E ②B+G
(2)若A 与 F、C与D、E与G它们两两之间属于同一类物质,B为另一类物质。
则F的化学式 ;写出 G→E反应的化学方程式 。
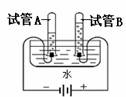
29.(共7分)自然界中人与动物的生存都离不开氧气。
(1)核潜艇舱室中氧气的来源主要靠电解水制得(原理如下图)。①正极收集的气体是 ,②A试管和B试管中收集到的气体的体积比约等于___________,③水是由 组成的。
(2)过氧化钠(Na2O2)可作为宇航员供氧剂。它与人体呼出的二氧化碳气体反应生成氧气和另一种能用于造纸、纺织等生产的物质,这种物质的俗名为 。
(3)亚氯酸钠(NaClO2)不仅可以制得氧气,还可用于漂白杀菌,其中氯元素的化合价为 。
(4)过氧化钙(CaO2)用于鱼池供氧剂,同时有熟石灰生成。
①写出过氧化钙与水反应的化学方程式 。
②现将7.2 g过氧化钙放入36.0 g水中,使之充分反应,所得混合物中氧元素的质量分数 (结果保留一位小数)。
28.(共4分)下列数据是四种固体物质在20℃时的溶解度。
|
物质名称 |
氯化铵 |
硝酸钾 |
氯化钾 |
氯化钠 |
|
化学式 |
NH4Cl |
KNO3 |
KCl |
NaCl |
|
溶解度(g) |
37.2 |
31.6 |
34.0 |
36.0 |
(1)20℃时,分别向盛有100 g水的四个烧杯中加入34.0 g上述四种物质,充分溶解后,一定能得到饱和溶液的是 (填化学式)。
(2)质量分数为25%的氯化钠溶液,其溶质与溶剂的质量比为 。
(3)甲图烧杯A中是20℃时硝酸钾的饱和溶液,乙图是硝酸钾溶液的溶解度曲线,a、 b分别表示硝酸钾的两种状态。下列做法能实现a转化为b的是 (填字母)。
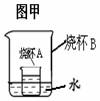
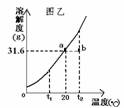
A.向烧杯B中加一定量的浓硫酸 B.向烧杯A中加一定量的水
C.向烧杯B中加一定量的硝酸铵固体 D.向烧杯B中加一定量的氯化钠固体
E.向烧杯B中加一定量的氧化钙固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com