
18.(9分)饱和氯水与石灰石的反应是制取较浓的HclO溶液方法之一。某同学运用这一方法,尝试制取HC1O溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验;
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生;
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HclO的原因
。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份: 。
第二份: 。
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式) 。
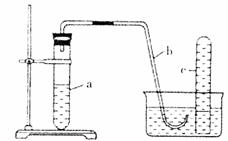 19.(10分)用如图所示装置进行下列实验。
19.(10分)用如图所示装置进行下列实验。
(1)在检查装置所密性后,向试管a中加入10mL6mol·L-1稀硝酸和lg铜片,立即将带有导管的橡皮塞塞紧管口。请写出试管a中有可能发生的所有反应的化学方程式
。
(2)该实验刚开始速率缓慢,随后逐渐加快,这是由于
。
(3)为了使产生的气体不至于逸散到空气中,请写出向试管a中加入试剂的操作方法
。
(4)欲较快地制取NO,可采取的措施有(列举两种) 、
。
17.在烧杯中加入铁和铜的混合物,然后加入一定量的稀硝酸,充分反应后,剩余金属的质量为m1g;再向该烧杯中加入一定量的醋酸,充分振荡后剩余的金属质量为m2g。则m1与m2之间的关系一定正确的是 ( )
A.m1可能等于m2 B.m1一定等于m2
C.m1可能大于m2 D.m1一定大于m2
第Ⅱ卷(非选择题,共54分)
16.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是 ( )
A.均增加1 mol B.均减少1 mol C.均减半 D.均加倍
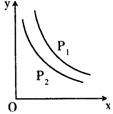
15.反应:L(s)+aG(g) bR(g)达到平衡时,温度和压
强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温
度,y轴表示混合气体中G的体积分数。据此可判断:①该反
应的正反应是放热反应;②该反应的正反应是吸热反应;③b<a;
④a<b上述说法正确的是 ( )
 A.①③ B.①④ C.②③ D.②④
A.①③ B.①④ C.②③ D.②④
14.某研究性学习小组为了探索镁粉与FeCl3溶液的反应机理,做了如下两组实验:①将镁粉投入冷水中,未见明显现象;②将镁粉投入FeCl3y溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀。则下列有关镁与FeCl3溶液反应的叙述中,正确的是 ( )
A.镁只与FeCl3溶液中的Fe3+直接反应
B.气泡是镁与FeCl3溶液中的水直接反应产生的
 C.红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得
C.红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得
 D.汽泡是镁与FeCl3水解生成的盐酸反应产生的
D.汽泡是镁与FeCl3水解生成的盐酸反应产生的
13.有M、R两种主族元素,已知M2-离子与R+离子核外电子数之和为20,下列说法正确的是 ( )
A.若M在第3周期,则R一定在第2周期
B.M与R的质子数之和为20
C.M2-可能比R+的离子半径小
D.M与R的原子序数之差可能等于7
12.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g)。已知H2和I2的起始浓度均为0.20mol·L-1时,达平衡时HI的浓度为0.32mol·L-1,若H2和I2的起始浓度均为0.40mol·L-1时,则平衡时H2的浓度(mol·L-1)是( )
A.0.08 B.0.16 C.0.32 D.0.04
11.在已知AgCl和AgCrO4的溶度积分别为1.8×10-10mol-2和2.0×10-12mol3·L-3。若用难溶盐在溶液中的浓度来表示其溶解度,则下列叙述正确的是 ( )
A.AgCl和AgCrO4的溶解度相等
B.AgCl的溶解度大于AgCrO4
C.两者类型不同,不能直接由Ksp的大小来判断其溶解能力的大小
 D.都是难溶盐,溶解度无意义
D.都是难溶盐,溶解度无意义
10.相同温度、相同物质的量浓度的四种溶液:①CH3COONa②NaHSO4③NaNO3④NH4Cl按pH值由大到小的顺序排列,正确的是 ( )
A.④>①>③>② B.①>④>③>②
C.①>③>④>② D.④>③>①>②
9.下列各组物质在适宜的条件下反应,其中氧化剂和还原剂的物质的量之比为2 :1的是
( )
A.CuO+CO B.H2SO4(浓)+C
C.Mg+CO2 D.Fe2O3+Al
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com