
4.下列有关硫酸工业制法的说法中错误的是
A.预热从接触室出来的混合气体,有利于被浓硫酸吸收
B.黄铁矿在加入沸腾炉前需粉碎,其目的是提高原料的利用率
C.SO2跟O2是在催化剂(如V2O5等)表面上接触时发生反应的
D.用98.3%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3.
3.下列物质:①干冰,②石英,③白磷,④氯仿,⑤过氧化钠。其中含极性键的非极性分子是
A.②③⑤ B.仅②③ C.仅① D.①③④
2. 下列事实不能用勒沙特列原理解释的是
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C. 实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
1. 据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2中含18个中子 B. 原子半径:N<18O
C. N5和N2互为同位素 D. 2N5 = 5N2是化学变化
27.计算题(13分)
有四种质量比可能相同或不同的镁铝合金样品①、②、③、④。甲、乙、丙、丁四位同学各取一种样品,进行下列实验,求合金中镁的质量分数。
(1)甲同学取样品①m1g和过量的氢氧化钠溶液反应,然后过滤,再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体m1g则合金中镁的质量分数是 。
(2)乙同学取样品②m2g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体m2g,则合金中镁的质量分数是 。
(3)丙取样品m3g与足量的稀硫酸反应,发现固体完全溶解,在标准状况下得到气体VL,则m3的取值范围是 。
(4)丁取不同质量的样品④分别和30mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下表所示:
|
实验序号 |
a |
b |
c |
|
合金质量(mg) |
510 |
765 |
918 |
|
气体体积(mL) |
560 |
672 |
672 |
分析上表数据后填空:
①a中的盐酸 c中的盐酸 (填“过量”还是“不足量” )
②盐酸的物质的量浓度为 合金中的镁与铝的物质的量比为 镁的质量分数为 。
③在c组实验之后,还需向容器中加入1.00mol/L 的氢氧化钠溶液 才能使合金中的铝恰好完全溶解?
26.(8分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。W是由两种短周期元素组成,其与水的反应可类比电石与水的反应。乙通常是一种红棕色粉末。G为白色胶状沉淀。W、G、H、I三种物质中都含有同一种短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比是1∶2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
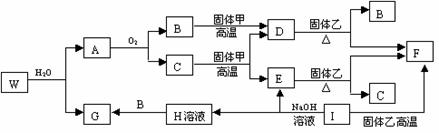

⑴ B的电子式为 ,I原子的结构示意图______________。
⑵据上述转化关系图C→E、D→F、E→F、I→F、I→E、A→B 等反应按要求写出下列反应方程式。
非金属元素之间的置换反应_______________________________________;
金属单质制备非金属单质的反应___________________________________;
⑶ 写出W和水反应的化学方程式__________________________________。
25.(6分)pH=1的溶液x中含有三种常见金属阳离子,用x溶液进行如下实验:
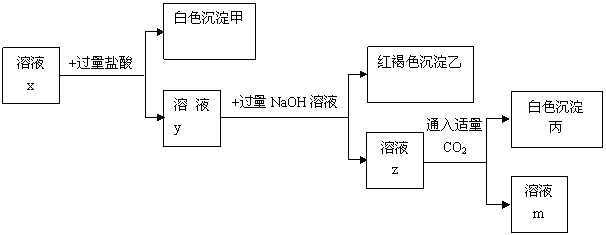
(1)根据有白色沉淀甲生成,可判断x溶液中有阳离子 ,阴离子 。
(2)综合分析有红褐色沉淀乙生成, (填“能”或“不能”)确定x溶液中的一种金属阳离子,理由是
。
(3) 根据有白色沉淀丙生成,可判断x溶液中可能有阳离子 。
24.(12分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号 Y Z
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
23.(13分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
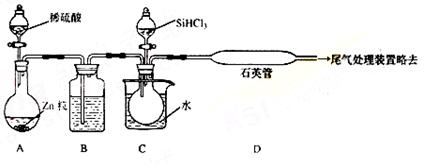
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
三推断题(共三小题26分)
22.(5分)铝及其化合物在生活中有着广泛应用。在我国南方某些地区,当地居民常采用往水中加明矾的方法来处理水中的悬浮杂质。其原理为
。明矾处理后的水中含有较多的阴离子为 ;写出用化学方法验证水中含有这种阴离子的操作和现象: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com