
6. 氢元素与其它元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
氢元素与其它元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
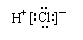 A.一个D2O分子所含的中子数为8
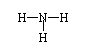
B.NH3的结构式为
A.一个D2O分子所含的中子数为8
B.NH3的结构式为
C.HCl的电子式为 D.热稳定性:H2S > HF
5.湿润的KI-淀粉试纸接触某气体而显蓝色,该气体中可能是( )
①Cl2 ②NO2 ③H2S ④SO2 ⑤HCl ⑥溴蒸气
A.①③④ B.①②⑤ C.①②⑥ D.②④⑤
4.以NA表示阿伏加德罗常数,下列说法正确的是( )
A.0.1mol H3O+ 中含有NA个电子
B.标准状况下,11.2 L臭氧中含有NA个氧原子
C.1.8g水(H218O)含有NA个中子
D.84 g NaHCO3晶体中含有NA个CO32-
3.某烧碱溶液中含有少量杂质纯碱,要除去此杂质需要加适量的下列试剂( )
A.CaCl2溶液 B.Ba(NO3)2溶液 C.Ca(OH)2溶液 D.稀盐酸
2.碱金属与卤素所形成的化合物大都具有的性质是( )
①高沸点;②能溶于水;③水溶液能导电;④低熔点;⑤熔融状态不导电。
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
1.关于氢键,下列说法正确的是( )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.没有氢键就没有生命
D.H2O是一种非常稳定的化合物,这是由于氢键所致
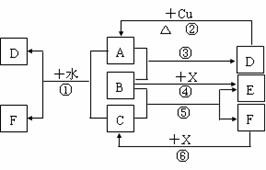
22.(10分)已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
|
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是 ;
(2)F的电子式为 ;
(3)写出反应②的化学方程式 ;
(4)写出反应①、⑥的离子方程式
① ;
⑥ 。
21.(12分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
(1)写出C与D所形成的化合物的电子式 。
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
_____________ > ______________ 。
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的化学方程式:_____________________________________________________________ 。
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应、且生成气体的离子方程式:_______________________________________________________。
(5)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池的电极反应方程式:
负极 :____________________________________;
正极 :_______________________________________。
19.(10分)X、Y、Z三种短周期元素的原子序数为X>Y>Z, Z原子次外层电子数是最外层电子数的1/3,这三种元素原子核电荷数总和为39,且X的一种氧化物A跟水反应后可生成具有还原性的不稳定的二元酸。
(1)试推断这三种元素是X ,Y ,Z (填元素符号)
(2)B和A的组成元素相同,A氧化为B的化学方程式是 ;C是Y的氧化物,1molC在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和;在一定条件下,B可以跟单质Y反应生成A和C,该反应的化学方程式是 。
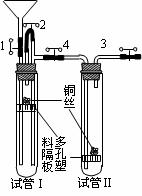
|
①检查装置的气密性;
②打开1、2、3、4,经漏斗加入稀硝酸,直至酸液充满试管I;
③关闭1、2,打开3、4,用酒精灯微热试管I,当
铜丝表面有气泡产生时,立即撤去酒精灯;
④随着反应进行,I中液体会流入II并浸没隔板上的铜丝,此时立即加热试管II,即可看到II中有红棕色气体产生。当红棕色气体充满II后,立即关闭3;
⑤一段时间后,关闭4并撤去酒精灯,将试管II(连同塞子及止水夹3、4)浸入盛有冰水的大烧杯中。
试回答下列问题:
(1)步骤②中稀硝酸要充满试管I的目的是_______________________________ 。
(2)步骤③中发生反应的离子方程式为_________________________________________。
(3)步骤④中产生红棕色气体的化学方程式是_________________________________。
该步骤中关闭3产生的结果是___________________________________________。
(4)实验中观察到初始阶段步骤④中产生气体的速率明显快于步骤③,你认为其可能的原因是_____________________________________________。(写出一条即可)
(5)步骤⑤中可观察到的主要现象是_________________________________________。
18.有四种氯化物,它们的通式为XCl2,其中最可能是第IIA族元素的氯化物是 ( )
A.白色固体,熔点低,完全溶于水,得到一种无色中性溶液,此溶液导电性差
B.绿色固体,熔点高,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性
C.白色固体,极易升华,如与水接触,可慢慢分解
D.白色固体,熔点较高,易溶于水,得无色中性溶液,此溶液具有良好的导电性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com