
28.(6分) A、B、C、和D都是周期表中前20号元素,已知:
①A的阳离子D的阴离子具有相同的核外电子排布,且能形成组成为AD的化合物;
②B和D属同族元素,它们能形成两种常见化合物;
③C和B属同一周期元素,它们能形成两种气态化合物:
④C和B、D和B、A和C、C和D都能形成组成为WX2型的化合物;
⑤它们形成WX2型的化合物中有一种是实验室制取某种气体的原料,有一种是有机溶剂。
请回答:
(1)化合物AD和AC2的化学式分别是 和 。
(2)写出实验室以AC2为原料制取气体的化学方程式 。
(3)B和D形成的两种常见化合物的分子式是 和 。
(4)写出D和B形成的一种气态化合物跟AB反应的化学方程式:
27.(8分)甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示。已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属。②通常状况下,X是无色液体,Y是黑色晶体。③丙在乙中燃烧发出苍白色火焰。
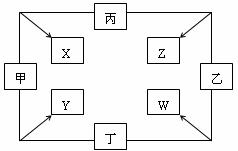
(1)红热的丁和乙反应的现象为 ,过量的丁与W反应的离子方程式为 。
(2)Y与Z的溶液反应的离子方程式为 ,比较Z与乙的氧化性强弱的实验事实为 。
(3)将少量W的饱和溶液滴入沸腾的X中,得到红褐色液体,反应的离子方程式为
。
26.(9分)2006年8月末,甘肃省徽县水阳乡有373名儿童被诊断为重度铅中毒。国家环保总局派出专家调查认为,水阳乡新寺村旁的一家铅锭冶炼厂是“罪魁祸首”, 铅锭冶炼厂周边土地已全部被污染。《东方时空》、《焦点访谈》专门对此做了报道,血铅超标的病人正在接受有效治疗。
(1)铅位于周期表的 周期 族,已知+2价铅比+4价铅稳定,即+4价铅有较强的氧化性。将PbO2与浓盐酸加热产生黄绿色的气体,写出该反应的离子方程式
,
将SO2通入棕色PbO2的悬浊液会产生白色沉淀,写出该反应的化学方程式
。
(2)铅在自然界主要以方铅矿(PbS)存在,铅锭冶炼厂主要采用火法冶炼铅,其主要过程是先煅烧方铅矿制氧化铅,再用CO还原氧化铅制铅。请写出上述过程有关的化学方程式 , 。
25.(7分)图中的每一方格表示有关的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。已知常温下B、C为气态单质,G为固态单质,其余均为化合物。A是由2种短周期元素组成的离子化合物。B形成的氧化物的总电子数比F的总电子数少8。请填写下列空格:
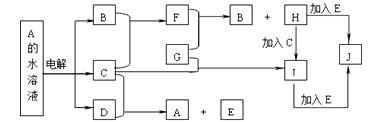
(1)E是_________,I是_________,I溶液蒸干并灼烧,所得固体是 (均填化学式)。
(2)写出C的水溶液与SO2反应的离子方程式
(3)写出I+E-J在水溶液中反应的离子方程式 。
24.(12分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
|
b |
|
|
|||||||||||||||
|
|
|
|
|
h |
|
j |
|
|
|||||||||
|
a |
c |
|
f |
g |
|
i |
k |
l |
|||||||||
|
|
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出表中所有代表金属元素的元素符号 ;
(2)表中各元素的单质中,属于分子晶体的有 (写分子式)。
(3)写出h与i元素组成的分子的电子式 ,该分子属于
(极性、非极性)分子。
(4)写出满足以下要求的3个置换反应的化学方程式:①从表内短周期元素中挑选出6种单质,②6种单质分属6个不同的主族。 ;
; 。
23.(5分)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化产物是
(2)如果该反应方程式中I2和KIO3的化学计量数都是5;①KMnO4的化学计量数是 ;②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
22.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Cl─、Mg2+、Ba2+、SO42─、CO32─,现取三份100mL溶液进行如下实验:⑴ 第一份加入AgNO3(aq)有沉淀产生;⑵ 第二份加足量NaOH(aq)加热后,收集到气体0.04mol;⑶ 第三份加足量BaCl2(aq)后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是: ( )
A.K+一定存在 B.100mL溶液中含有0.01mol CO32─
C.Cl─ 一定存在 D.Ba2+一定不存在,Mg2+可能存在
|
21.欲使NaHCO3稀溶液中H+、CO32─、HCO3─的浓度均减少,可加入或通入: ( )
A.NaOH固体 B.澄清石灰水 C.浓盐酸 D.CO2
20.在100 mL FeI2溶液中缓缓通人标准状况下的氯气3.36 L,反应完全后,溶液中有一半的Fe2+被氧化生成Fe3+,则原来FeI2溶液的物质的量浓度为: ( )
A.l.0 mol·L─1 B.1.2 mol·L─1 C.1.5 mol·L─1 D.0.6 mol·L─1
19.下列各组离了在溶液中能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是: ( )
A.Fe2+、K+、SO42─、Cl─ B.Ca2+、Mg2+、HCO3─、NO3─
C.Al3+、Na+、SO42─、NO3─ D.K+、Na+、SiO32─、AlO2─
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com