
17.(6分)在一定条件下,向密闭容器中通入2molSO2和1molO2,当反应达到平衡时,测得SO2的转化率为50%,反应放出98.5kJ的热量。
该反应的热化学方程式为 。
现有容积相同的甲、乙两个定容容器,在上述条件下分别充入的气体的物质的量和反应放出的热量(Q)如下表
|
容器 |
n(SO2)/mol |
n(O2)/mol |
n(SO3)/mol |
Q/kJ |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
根据以上数据,下列叙述正确的是 。
A.在上述条件下,反应生成1molSO3放热98.5kJ
B.Q1<197
C.Q1=2Q2
D.Q1>Q2
16.将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应NO2(g)+CO(g)
 CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是 ( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是 ( )
A.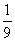 B.
B.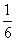 C.
C.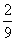 D.
D.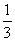
|
15.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,ClO-把Ni2+氧化生成Ni2O3。以下说法正确的是 ( )
A.ClO-把Ni2+氧化生成Ni2O3时反应的离子方程式是
ClO-+2Ni2++4OH-= Ni2O3+Cl-+2H2O
B.可用铁作阳极材料
C.电解过程中阳极附近溶液的pH升高
D.每生成1mol Ni2O3,外电路中转移1mol电子
14.将V1mL 0.50mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是 ( )
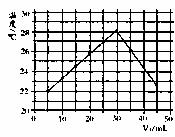
A.根据上述实验数据可以计算出盐酸和氢氧化钠反应热
B.该实验表明有水生成的反应都是放热反应
C.NaOH溶液的浓度约为1.5mol·L-1
D.该实验表明化学能可能转化为热能
13. 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。反应过程中,甲醇的物质的量与时间的关系如下图所示。下列判断正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。反应过程中,甲醇的物质的量与时间的关系如下图所示。下列判断正确的是( )
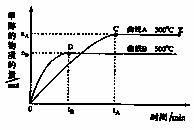
A.升高温度,K值增大
B.在500℃时,从反应开始到平衡, 氢气的平
均反应速率v(H2)=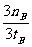 mol·L-1·min-1
mol·L-1·min-1
C.在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/3,甲醇的物质的量减少
 D.由于Cu2O+CO 2Cu+CO2,所以反应体系中含少量CO2不利于维持催化剂Cu2O的量不变
D.由于Cu2O+CO 2Cu+CO2,所以反应体系中含少量CO2不利于维持催化剂Cu2O的量不变
12.已知31g红磷(P,固体)在氧气中燃烧生成P4O10固体放出738.5kJ热量,31g白磷(P4,固体)在氧气中燃烧生成P4O10固体放出745.8kJ热量。下列判断正确的是 ( )
A.白磷在氧气中燃烧的热化学方程式是P4(s)+5O2(g)=P4O10(s) △H=-745.8kJ·mol-1
B.红磷转化成白磷时放出热量
C.红磷比白磷稳定
D.31g红磷中蕴含的能量为738.5kJ
11. 反应H2(g)+I2(g) 2HI(g)在450℃时,化学平衡常数是49。则反应HI(g)
反应H2(g)+I2(g) 2HI(g)在450℃时,化学平衡常数是49。则反应HI(g)

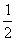 H2(g)+
H2(g)+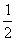 I2(g)在450℃时的化学平衡常数是 ( )
I2(g)在450℃时的化学平衡常数是 ( )
A.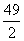 B.
B.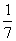 C.7 D.
C.7 D.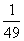
9.我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下欠的腐蚀的叙述不正确的是
( )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+2e-→4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe→Fe2++2e-
|
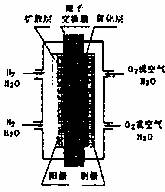
A.工作时“阳极”周围溶液的酸性增强
B.氢气在电极上发生还原反应
C.图中标出的“阴极”实际是原电池的负极
D.工作过程中,质子(H+)从“阴极”一边透过质子交换膜移动到“阳极”一边与OH-反应生成水
8.下列叙述中,不正确的是 ( )
A.钢铁在干燥的环境中不易腐蚀
B.原电池工作时,电解质溶液中的阳离子移向正极
C.用铝质铆钉铆接铁板,铆接处的铁板更易被腐蚀
D.集中回收处理废旧电池的主要目的是防止电池中的重金属离子污染土壤和水源
7.催化剂之所以能加快反应速率,是因为 ( )
A.减小了反应速率常数 B.降低了反应的活化能
C.降低了反应的焓 D.降低了反应的熵
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com