
3.等体积混合0.1mol/L的盐酸和0.06mol/L的Ba(OH)2溶液后,溶液的pH等于( )
A.2.0 B.12.3 C.1.7 D.12.0
2.常温下,某溶液水电离出c(OH)-=1×10-13mol/L,对该溶液叙述正确的是 ( )
A.溶液一定是显酸性 B.溶液一定是显碱性
C.溶液一定不显中性 D.溶液可能是pH=7的溶液
1.下列说法正确的是 ( )
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.碳酸钙难溶于水,但它是强电解质
D.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
25.(12分)合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡。
⑴ 合成氨反应的热化学方程式如下:N2(g)+3H2(g)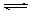 2NH3(g) ΔH=-92.4kJ/mol。为了提高NH3的产率,应如何选择反应条件
;
2NH3(g) ΔH=-92.4kJ/mol。为了提高NH3的产率,应如何选择反应条件
;
⑵ 在一密闭容器中以体积比1∶3通入氮氢混合气体,使N2的物质的量浓度为amol/L。在一定条件下发生反应,经ts后达到化学平衡,混合气体中NH3的体积分数为b。则从反应开始至达到化学平衡时H2的平均反应速率为 ,该条件下反应的平衡常数K= (用含a、b的函数式表示,不必化简)。
⑶ 液氨与水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为:
2NH3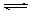 NH4++ NH2ˉ(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4=
。
NH4++ NH2ˉ(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4=
。
24.(12分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
⑴ 化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
⑵ 已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
⑶ 有下图所示的装置:
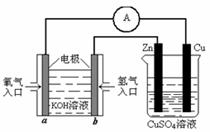
该装置中Cu极为 极;当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为 L。
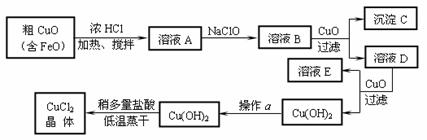
23.(8分)工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
⑴ 溶液A中加入NaClO的目的是 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
22.(12分)下图是部分化学常见的氧化物和单质的转化关系。其中氧化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题:
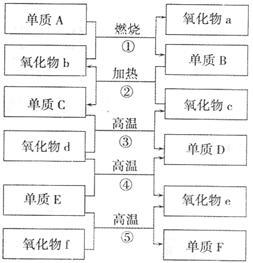
(1)写出下列物质的化学式:单质C 氧化物d ;
(2)纯净的单质F在工业上的重要应用是 ;
(3)写出下列反应的化学方程式:
① ;
④ ;
⑤ 。
20.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:X(g)+Y(g)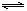 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A.升高温度,Z的体积分数增大
B.增大压强,Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
|
(1)写出实验室中制取氯气的离子方程式 ;
(2)实验室也可以利用如下反应制取氯气:KC1O3+6HC1(浓) KC1+3C12↑+3H2O。若制取标准状况下的6.72L氯气,该反应中电子转移的物质的量为
;
(3)某同学用排空气法收集一瓶氯气,进行氯气与铁反应的实验:取一根细铁丝 ,然后立即伸入充满氯气的集气瓶中,观察到的现象是 。
为观察生成的氯化铁溶液的颜色,向反应后的集气瓶中加入少量的蒸馏水,振荡,实际观察到的现象是 ,
产生这种现象的原因是 ;
为真正观察到氯化铁溶液的颜色,应向反应后的集气瓶中改加(填试剂名称) 。
19.向1.00 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中( )
A.溶质为Na2CO3
B.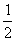 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.溶质为H2CO3、NaHCO3 D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H +)
18. 下列实验的设计不可行的是(
)
下列实验的设计不可行的是(
)
A.在浓氨水中加入生石灰可以制取少量的NH3
B.用水就一次性鉴别溴苯、苯、乙酸三种物质
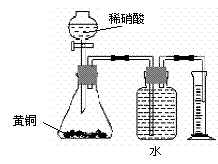
C.用如图所示的装置测定黄铜(Cu、Zn合金)中Zn的含量
D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com