
1.航天科学家正在考虑用特种塑料代替金属材料制造航天飞船,进行太空探索。下列各项说法中,明显支持上述设想的是 ( )
A.塑料是一种高分子化合物
B.加入某些添加剂用特殊方法可制得性能比合金优良的新型塑料
C.塑料可以通过人工合成制得
D.塑料不和强酸、强碱作用
27.(9分)合成氨工业对化学工业和国防工业具有重要意义。
(1)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆过程
_______________________________________________________________
②氨水中水电离出的 (填写“>”、“<”或“=”)
(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为__________________。
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式___________________________;
②在标准状况下,每生成1mol B,转移电子的物质的量为_________mol。
(3)I 在某压强恒定的密闭容器中加入2mol N2和4 mol H2,发生如下反应: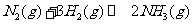
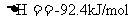
达到平衡时,体积为反应前的三分之二。求:
①达到平衡时,N2的转化率为_________。
②若向该容器中加入amol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:
①_________②(填“>”、“<”或“=”)。
Ⅱ 若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与I相同的温度下达到平衡。
③试比较平衡时NH3的浓度I_________Ⅱ (填“>”、“<”或“=”)。
26.(13分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
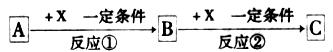
试回答:
(1)若X是强氧化性单质,则A不可能是_________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向c的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为_________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)__________________,检验此C溶液中金属元素价态的操作方法是____________________________________。
(3)若A、B、C为含有金属元素的元机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式可能为_________,X的化学式可能为(写出不同类物质)_________或_________,反应①的离子方程式为_________或_________。
25.(16分)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。
请回答下列问题:
(1)D的最高价氧化物对应水化物名称为__________________。
(2)C2B2的电子式为_________,其中含有的化学键类型为_________。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入Ⅺ淀粉溶液中,溶液变为蓝色,则反应离子方程式为_________。
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为____________________,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为_________,外电路中通过电子的物质的量为_________。
(5)实验室欲检验CD溶液中所含的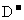 ,操作方法和现象为_______________________
,操作方法和现象为_______________________
24.(14分)某研究性学习小组对铝热反应实验展开研究。某高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答_________(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_________,反应的离子方程式为___________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol· L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试回答下列问题:
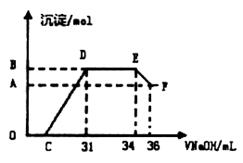
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_________;上述现象说明溶液中的离子结合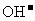 的能力最强的是________最弱的是________(填离子符号)。
的能力最强的是________最弱的是________(填离子符号)。
(3)B与A的差值为_________mol。
23.(4分)下列实验操作或事故处理中,正确的做法是_________
A.银镜反应实验后附有银的试管,可用氨水清洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.在250mL烧杯中加入216mL水和24gNaOH固体,配制质量分数为l0%NaOH溶液
F.发生急性硫化氢中毒,应迅速将患者转移到空气新鲜的地方,对患者实行人工呼吸,并迅速送医院救治。
G.用结晶法可以除去硝酸钾中混有的少量氯化钠
H.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
I.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
22.在某容积一定的密闭容器中,可逆反应: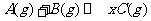
 ,符合下图所示图像(1)的关系。由此推断对图像(2)的正确说法是( )
,符合下图所示图像(1)的关系。由此推断对图像(2)的正确说法是( )
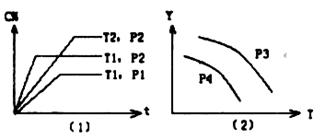
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示B的百分含量
C.P3>P4,Y轴表示混合气体密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
第Ⅱ卷 (非选择题 共56分)
21.在恒容条件下化学反应: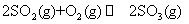
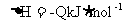 在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是( )
在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是( )
|
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
l |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
l |
Q3 |
A.在上述条件下反应生成1molSO3固体放热Q/2kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
20.氢化铵(NH4H)与氯化铵的结构相似,又如NH4H与水反应有氢气生成,下列叙述正确的是( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是氧化剂
D.NH4H固体投入少量水中,有两种气体生成
19.常温下,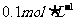 某一元酸(HA)溶液中
某一元酸(HA)溶液中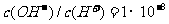 ,下列叙述正确的是( )
,下列叙述正确的是( )
A.溶液中水电离出的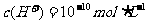
B.溶液中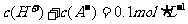
C.与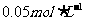 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:
NaOH溶液等体积混合后所得溶液中离子浓度大小关系为: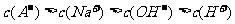
D.原溶液中加入一定量CH3COONa晶体或加水稀释,溶液的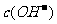 均增大
均增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com