
14.下图中a、b、c、d、e为周期表前四周期的部分元素,下列叙述正确的是 ( )
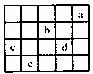
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的性质最稳定
C.b、d气态氢化物溶于水,溶液的酸性:b>d
D.e元素最高价氧化物的水化物和不同量的氢氧化钠反应,可能生成三种盐
13.图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中不正确的是
( )
A.根据金属活动顺序表,判断金属能否转换出稀硫酸中的氢
B.根据熔点数据表,判断降低温度时,两种固体混合物的水溶液中哪种物质先析出
C.根据元素周期表,判断同主族两种元素的阳离子在用惰性电极电解其水溶液时,何
者先发生反应
D.根据酸碱盐的溶解性表,判断某些复分解反应能否发生
12.25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va<Vb。下列有关a的说法正确的是 ( )
A.a可能等于1 B.a一定大于2 C.a一定小于2 D.a一定等于2
11.下列各组离子可能大量共存的是 ( )
A.pH=1的溶液中:Fe2+、Al3+、HCO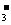 、MnO
、MnO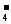
B.能与金属铝反应放出氢气的溶液中:K+、NO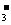 、Cl-、NH
、Cl-、NH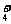
C.含有大量OH-的无色溶液中:Na+、Cu2+、[Al(OH)4]-、SiO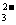
D.常温下水电离出的离子浓度符合c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、
SO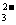
8.NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.含0.4mol硝酸与0.3mol硫酸的混合稀溶液与足量铜反应转移电子数为0.3NA
B.1 L 0.5mol·L-1的(NH4)2SO4溶液中含有NA个NH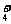
C.在镁与二氧化碳的反应中,1mol镁失去的电子数为2NA
D.1mol氢氧根离子中含有8NA个电子
|
A.二氧化锰与浓盐酸反应制氯气:MnO2+4HCl(液) Mn2++Cl2↑+2H2O+2Cl-
B.硫酸铜溶液吸收硫化氢气体:Cu2++S2-=CuS↓
C.氯化铁水解:Fe3++3H2O=Fe(OH)3↓+3H+
D.钠投入水中:2Na+2H2O=2Na++2OH-+H2↑
|
A.反应后溶液中Cu2+与Fe2+的物质的量之比为1:2
B.氧化性:Ag+>Cu2+>Fe3+>Zn2+
C.含Fe3的溶液可腐蚀铜板
D.1molFe要还原2molFe3+
7.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是 ( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
6.从海水中提镁,最基本的方法是往海水里加碱,得到Mg(OH)2沉淀,将沉淀分离出来,加入盐酸使其转化成MgCl2溶液,经蒸发、结晶、过滤、干燥、电解,得到金属镁。下列关于从海水中提镁的说法正确的是 ( )
A.整个过程中没有涉及转换反应
B.往海水里加碱是指加入NaOH
C.电解MgCl2溶液即可得到金属镁
D.电解时得到的镁蒸气应在CO2氛围中冷却
5. 已知可逆反应aA+bB cC,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
( )
已知可逆反应aA+bB cC,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
( )
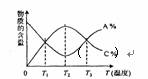
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.升高温度,平衡向正反应方向移动
D.该反应的正反应是吸热反应
4.用惰性电极电解下列物质的稀溶液,经过一段时间后,溶液的pH减小的是 ( )
A.Na2SO4 B.NaOH C.NaCl D.AgNO3
3.下列各组微粒,按半径由大到小顺序排列的是 ( )
A.Mg、Ca、K、Na B.S2-、Cl-、K+、Na+
C.Br-、Br、Cl、S D.Na+、Al3+、Cl-、F-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com