
28.(15分)下图表示各物质之间的转化关系。已知:C、E、I、K为无色气体,H为黄绿色气体,反应③④为常见的工业反应,A是由短周期元素组成的X2Y2型化合物,J为红棕色固体。
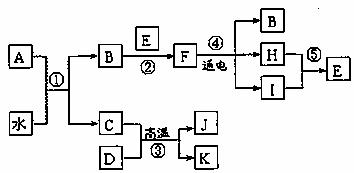
按要求填空:
(1)A的电子式是 。
(2)反应③的化学方程式是 。
(3)实验室检测K的方法是 。
(4)反应①~⑤中,属于氧还原反应的有 ,其中有一个反应在产物中有两种单质生成,试写出其化学方程式并标出电子转移的方向和数目 。
27.(15分)I.(1)在a~d的几种定量仪器中,仪器上标有温度的是 。(填写编号,不同)
(a)容量瓶 (b)滴定管 (c)托盘天平 (d)温度计
(2)在以下实验操作中错误的是 。
A.读取量筒中液体的体积时,仰视读数
B.实验室制乙烯时,温度计的水银球与烧瓶底部接触
C.测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上冷却
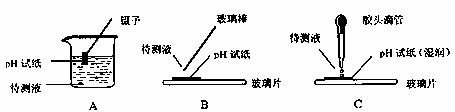
(3)在实验室中用pH试纸检测试液的操作正确的是 。
II.某澄清透明的溶液由K+、Fe3+、Ba2+、Al3+、I-、SO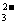 、SO
、SO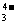 中的几种组成。现做以下实验:
中的几种组成。现做以下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色。
②取少量溶液,加入用稀HNO3酸化的BaCl3溶液,产生白色沉淀。
③将②过滤,向滤液中加入AgNO3溶液,产生白色沉淀。
④另取该溶液,逐滴加入NaOH溶液至过量,观察到有红褐色沉淀生成,且沉淀量不减少。
(1)溶液中肯定存在的离子有 。
(2)溶液中肯定不存在的离子有 。
(3)溶液中还不能确定是否存在的离子有 。
26.(15分)A、B、C、D、E为原子序数依次增大的五种短周期元素。E元素最高正价与最低负价的代数和为6,C单质既可与盐酸反应又可与NaOH溶液反应,C、E属同一周期,且能形成1:3型化合物;B原子的最外层电子数比次外层电子数多3;A、D原子序数相差8;若用A、B、D三种元素最高价氧化物分别与足量NaOH溶液反应,在得到的溶液中加入过量稀盐酸,只有一种溶液中能析出白色沉淀Y。
(1)写出E元素和钾元素形成的化合物的化学式 。
(2)C的氧化物与氢氧化钠溶液反应的离子方程式为 。
(3)将红热的A单质投入到B的最高价氧化物对应水化物浓溶液中发生反应的化学方程式为 。
(4)生成白色沉淀Y的离子方程式为 。
(5)在1molD的最高价氧化物形成的晶体中,含有共价键 mol。
13.有a、b两种有机物,其结构简式如下所示:
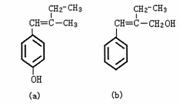
关于a、b两种有机物的下列说法中错误的是 ( )
A.鉴别a、b可用FeCl3溶液 B.a、b互为同分异构体
C.a、b均能与NaOH溶液反应 D.1mol a与浓溴水反应最多可消耗3mol Br2
第II卷(非选择题,共174分)
|
考生务必用黑色碳素笔在答题卡上作答. 在试卷上作答无效.
12.发射嫦娥一号卫星的运载火箭的第三级发动机使用低温燃料液氧和液氢。已知:1mol H-H键完全断裂需吸收436kJ能量,1molO=O键完全断裂需吸收能量496kJ,水蒸气中1molH-O键形成时放出能量463kJ。下列热化学反应方程式正确的是 ( )
A.2H2+O2=2H2O;△H=-1852kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=-1852kJ/mol
C.2H2(g)+O2(g)=2H2O(g);△H=+484kJ/mol
D.2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol
11.将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
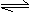 2HI(g);△H<0。10min后达到平衡,HI的体积分数Φ(HI)随时间变化如下图中曲线II所示。若改变反应条件,Φ(HI)的变化如图曲线I所示,则该条件可能是
2HI(g);△H<0。10min后达到平衡,HI的体积分数Φ(HI)随时间变化如下图中曲线II所示。若改变反应条件,Φ(HI)的变化如图曲线I所示,则该条件可能是
( )
A.恒容条件下升高温度 B.恒温恒容条件下加入适当的催化剂
C.恒温条件下扩大反应容器的体积 D.增大反应物中H2的浓度
9.某校研究性学习小组利用铁生锈原理设计了一个可给收音机供电的装置。在此装置中,下列说法正确的是 ( )
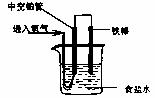
A.0.1mol Fe完全反应,转移电子0.3mol B.铁作阴极
C.正极反应式为:O2+2H2O+4e-=4OH- D.溶液中的Cl-移向正极
|
A.100mL 0.1mol/L NaCl溶液中含0.01NA个 Na+离子
B.标准状况下22.4L SO3含有的分子数为NA
C.20g重水(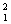 H2O)含有的分子数为8NA
H2O)含有的分子数为8NA
D.1mol Fe完全转化成Fe(OH)3胶体后,Fe(OH)3胶体微粒数为NA个
8.下列表示中正确的是 ( )
A.熔点:Na>Mg>Al;半径:Si<P<S
B.还原性:Be<Mg<Ca<Ba;氧化性:O>S>Se>Te
C.稳定性:HF>HCl>HBr>HI;沸点:HF>HCl>HBr>HI
D.酸性:HClO4>HBrO4>HIO4;碱性:NaOH>KOH>RbOH
7.下列离子方程式正确的是 ( )
A.Na与冷水反应:Na+2H2O=Na++2OH-+H2↑
B.硫化钠水解:S2-+2H2O=H2S+2OH-
C.石灰石溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两种溶液混合:
HCO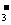 +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
6.下列叙述中错误的是 ( )
A.为保证加酶洗衣粉的洗涤效果,不能用沸水溶解加酶洗衣粉
B.使用乙醇汽油替代汽油可缓解能源危机并适度改善空气质量
C.臭氧杀菌能力强且不影响水质,是饮用水的理想消毒剂
D.光化学烟雾和酸雨的产生只与人为排放的硫氧化物有关
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com