
7.工业制硫酸时,接触室中装有热交换器,下列叙述与热交换器作用有关的是 ( )
A.有利于平衡向正反应方向移动,提高原料利用率
B.充分利用能量,降低生产成本,提高综合经济效益
C.降低温度,减小反应的速度
D.防止催化剂中毒
6.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应不符合绿色化学要求的是 ( )
A.处理硫酸厂尾气:SO2 + 2NH3+H2O = (NH4)2SO3
B.消除硝酸厂尾气污染:NO2+NO+2NaOH = 2NaNO2+H2O
 C.制硫酸铜:Cu+4HNO3(浓) = Cu(NO3)2
+ 2NO2↑+2H2O
C.制硫酸铜:Cu+4HNO3(浓) = Cu(NO3)2
+ 2NO2↑+2H2O
 D.制硫酸铜:2Cu + O2 2CuO,CuO + H2SO4(稀) CuSO4+H2O
D.制硫酸铜:2Cu + O2 2CuO,CuO + H2SO4(稀) CuSO4+H2O
5.人体血红蛋白中含Fe2+,如果误食亚硝酸盐(如NaNO2),会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐中的中毒,这说明维生素C具有 ( )
A.酸性 B.碱性 C.氧化性 D.还原性
4.氯化铁溶液和氢氧化铁胶体具有的共同性质是 ( )
A.能透过半透膜
B.呈红褐色
C.分散质粒子直径在1nm~100nm之间
D.加热蒸干、灼烧后都生成氧化铁
3.下列实验或现象中,可证明胶体粒子带有电荷的是 ( )
A.丁达尔效应 B.布朗运动
C.电泳现象 D.渗析
2.下列性质适合于分子晶体的是 ( )
A.熔点1070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电 ,水溶液能导电
C.难溶于溶剂中,熔点高于3550℃,沸点4827℃
D.熔点97.81℃,质软,导电、密度0.97g/cm3
1.下列各组物质发生指定的变化时,所克服的粒子间作用力完全相同的是 ( )
A.碘升华和干冰气化
B.石英熔化和冰熔化
C.蔗糖溶于水和硝酸钾熔化
D.氯化钠和氯化氧在水中电离
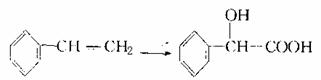
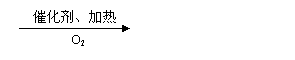
22.(13分)甲乙两位同学采取合作学习方式,共同研讨有机物的合成。其中,甲同学设计了以下路线合成某高分子化合物D:
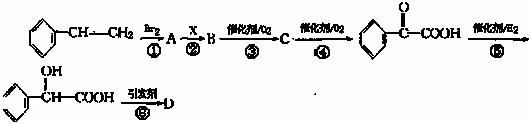
请回答下列问题:
(1)反应②使用的试剂X是 ;
(2)物质C的结构简式是 ,其中含有的含氧官能团有 ;
(3)写出反应⑥的化学方程式 ;
(4)乙同学通过分析,认为甲同学设计的步骤⑤存在明显缺陷。你认为,乙同学提出的缺陷是 ,
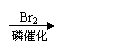 (5)甲乙两同学经过查阅资料,自学了解了以下知识:
(5)甲乙两同学经过查阅资料,自学了解了以下知识:
|
Br
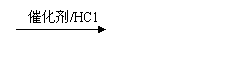
ⅡCH3-CH=CH2 CH3-CH2-CH2C1
请根据以上新知识学过的知识,设计反应流程图实现下列转化。
 说明:合成反应流程图表示方法示例如下:
说明:合成反应流程图表示方法示例如下:
CH3CH2OH CH3CHO……
21.(14分)
(1)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40-50℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成:Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 (填氧化剂或还原剂)。
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的化学方程式(不必配平) 。该反应中的氧化产物是 。
(2)下图中,P为一个可以自由滑动的活塞。关闭K,分别向A、B两容器中各充入2molX和2molY,在相同温度和有催化剂存在的条件下,两容器中各自发生如下反应:
 2X(g)+Y(g)
2Z(g)+2W(g)
2X(g)+Y(g)
2Z(g)+2W(g)
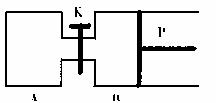
已知:起始时,VA=1L,VB=0.8L(连通管内的体积忽略不计),达到平衡时,VB=0.9L。回答下列问题:
①A、B两容器达到平衡的时间tA tB(填大于、小于或等于)
②计算该温度下反应的化学平衡常数K= ;
③当A、B分别达到平衡时,B容器中K的转化率为 ,两容器中W的体积分数关系为A B(填大于,小于或等于);
④打开K,一段时间后反应再次达到平衡,则此时B的体积为 。
20.(10分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为9。又知B、D、E分别与A、C两元素共同组成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1molM中含有42mol电子。回答下列问题:
(1)元素C在周期表中的位置是 ;
(2)化合物M中含有的化学键类型有 ;
(3)写出化合物Y与Z之间反应的离子方程式 ;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则正极上的电极反应式为 ;若以该电池作为电源,用惰性电极电解1L1mol·L-1的NaC1溶液,当溶液的pH=13时,理论上消耗元素A的单质在标准状况下的体积为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com