
18. 向甲乙两个容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB。相同条件下,发生下列反应:A(g)+2B(g)
XC(g);△H<0。测得两容器c(A)随时间t的变化如图所示,下列说法正确的 ( )
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB。相同条件下,发生下列反应:A(g)+2B(g)
XC(g);△H<0。测得两容器c(A)随时间t的变化如图所示,下列说法正确的 ( )
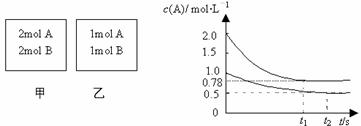
A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转化率降低
C.将乙容器单独升温,c(A)可达到0.78mol/L
D.若向甲容器中再充入2molA、4molB,平衡时甲容器中c(A)大于1.56mol/L
17.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应:
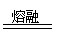 Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是
(
A.Na2O2既是氧化剂又是还原剂
Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是
(
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3mol Na2O2发生反应,有12mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
16.已知C2H5OH(g) = C2H5OH(l);△H1=Q1kJ/mol
H2O(g) = H2O(l);△H2=Q2kJ/mol
C2H5OH(g) + 3O2(g) = 2CO2(g) +3H2O(g);△H3=Q3kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量(/KJ)为 ( )
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5Q3+0.5Q2-0.5Q1 D.0.5Q1-1.5Q2-0.5Q3
15.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用,锌-锰碱性电池以KOH溶液为电解液,电池总反应为:Zn(s)+2MnO2(s)+2H2O(l) = 2MnOOH(s)+Zn(OH)2(s),下列说法错误的是 ( )
A.电池工作时,Zn为负极,失电子
B.电池正极的电极反应为:2MnO2(s)+2H2O(l) +2e-= 2MnOOH(s)+2OH-(aq)
C.电池放电过程中,负极周围溶液的pH不断增大
D.电池工作时,电子由负极通过电路流向正极
14.由一种阳离子与两种酸根离子组成的盐称为混盐。温盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的判断不正确的是 ( )
A.该混盐与硫酸反应产生1 mol Cl2时转移NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中的氯元素的化合价为-1
13.下列叙述正确的是 ( )
A.0.1mol·L-1醋酸溶液中,c(H+) = c(CH3COO-)
B.10mL 0.02mol·L-1HCl溶液与10mL 0.02mol·L-1CH3COONa溶液充分混合后,若混合后溶液的体积为20mL,则溶液的pH=2
C.在0.1mol·L-1CH3COONa溶液中,c(OH-) = c(CH3COO)+ c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
12.常温时,某溶液由水电离产生的c(H+)和c(OH-)分别为a mol·L-1和b mol·L-1且
a·b=10-28,该溶液中一定能大量共存的离子组是 ( )
①K+、Cl-、NO-3、S2- ②K+、Fe2+、I-、SO2-4
③Na2+、Cl-、NO-3、SO2-4 ④Na+、Ca2+、Cl-、HCO-3
⑤K+、Ba2+、Cl-、NO-3
A.①③ B.③⑤ C.③④ D.②⑤
11.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如下图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。据此判断,下列说法不正确的是 ( )
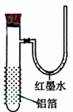
①实验中发生的反应都是置换反应
②铝是一种较活泼的金属
③铝与氧气反应放出大量的热量
④铝片上生成的白毛是氧化铝和氧化汞的混合物
A.①和② B.①和④
C.只有④ D.全部
9.X、Y两元素原子的L层电子数都等于它们其他层的电子数之和。下列推断正确的是( )
A.X与Y可能处于同一周期
B.X与Y可能处于同一主族
C.X与Y形成的单质不是分子晶体就是原子晶体
D.若X的原子序数大于Y的原子序数,则X可形成不同价态的氧化物
|
A.若混合溶液的pH=7,则c1·V1> c2·V2
B.若V1=V2,c1 = c2,则混合溶液中c(NH+4) = c(Cl-)
C.若混合溶液的pH=7,则混合溶液中c(NH+4) > c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
8.下列有关实验叙述正确的是 ( )
A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
B.加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
C.汽油或煤油存放在带橡皮塞的棕色玻璃瓶中
D.胶体粒子很小,可以透过半透膜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com