
4.一定能在下列溶液中大量共存的离子组是 ( )
A.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、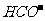 -
-
B.含有大量的溶液:Na+、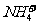 、
、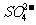 、
、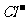
C.含有大量Fe3+的溶液:Na+、Mg2+、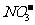 、
、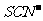 -
-
D.含有大量的溶液:H+、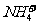 、
、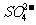 、
、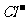
3.用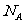 表示阿伏加德罗常数,下列说法中正确的是 ( )
表示阿伏加德罗常数,下列说法中正确的是 ( )
A.0.2mol过氧化氢完全分解转移的电子数目为0.4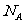
B.300mL 2mol/L蔗糖溶液中所含溶质分子数为0.6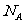
C.标准状况下,3.36L乙烷中含有的非极性键数为1.05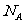
D.假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体粒数为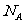
2. 下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是 ( )
A.0.1mol/L的NaOH溶液与0.1mol/L的CH3COOH溶液等体积混合
c(Na+)>c(OH-)>c(CHCOO-)>c(H+)
B.常温下,0.0lmol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液混合后使pH=7
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.0.1mol/L的CH3COOH溶液和0.1mol/L的CH3COONa溶液等体积混合
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
1.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
( )
A.植物油不能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
29.(12分)有Mg(OH)2(s)存在饱和溶液中,存在着如下平衡:
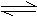 Mg(OH)2(s) Mg2++2OH-,向该饱和溶液中分别加入固体氯化铵时,固体氢氧化镁的质量减小,在说明原因时,甲、乙两同学存在着明显的分歧。
Mg(OH)2(s) Mg2++2OH-,向该饱和溶液中分别加入固体氯化铵时,固体氢氧化镁的质量减小,在说明原因时,甲、乙两同学存在着明显的分歧。
甲同学认为:氯化铵溶于水,电离出铵根离子,铵根离子发生下列水解:
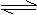 NH4++H2O NH3·H2O+H+,反应产生的氢离子和氢氧化镁反应:
NH4++H2O NH3·H2O+H+,反应产生的氢离子和氢氧化镁反应:
Mg(OH)2(s)+2H+ Mg2++2H2O,使Mg(OH)2(s)溶解。
乙同学认为:加入氯化铵固体后,氯化铵溶解并电离,溶液中存在大量的NH4+存在,
2NH4++Mg(OH)2 2NH3·H2O+Mg2+,促进Mg(OH)2溶解。
(1)你认为上述解释中 正确。(填“甲”或“乙”)。
(2)为了验证上述哪种解释正确,继续做如下实验:在上述氢氧化镁的悬浊液中加入酚酞试液,溶液变红,后逐渐滴加饱和氯化铵溶液,观察溶液颜色的变化和氢氧化镁固体的溶解情况。
若 (填现象),说明甲正确。
若 (填现象),说明乙正确。
(3)常温下,将0.01molNH4C1和0.04molNaOH溶于水,配成0.5L混合溶液(不考虑有气体生成),试判断:
①溶液中共有 种粒子。
②溶液中有两种粒子的物质的量之和一定等于0.01mol,它们是 和
。
③溶液中n(OH-)-n(OH4+)-n(H+) mol。
28.(16分)用硫酸处理铁屑所得到的溶液A,A中除Fe2+外,还含有一定量的Fe3+、Cu2+和Mn2+。今用A溶液制取硫酸亚铁晶体,并测定该晶体中结晶水的含量,实验方案如下:
实验1:制取硫酸亚铁晶体的过程如下图:
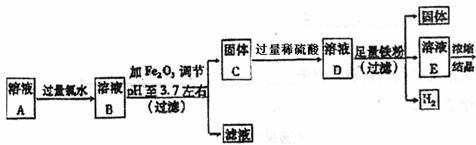
(1)往溶液A中加过量氯水的作用是 。
(2)下表是使一些金属离子转化为氢氧化物沉淀的pH,根据表中数据分析,固体C是 。
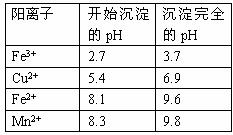
(3)有人提出,在处理溶液B时,先加
入几滴石蕊试液,然后逐滴加入NaOH溶液至溶液恰好由红色变为紫色(pH约为5),过滤即可得到固体C,你认为此方案是否可行 (填“行”或“不行” ),其理由是 。
实验2:用下图装置进行测定硫酸亚铁晶体(FeSO4·nH2O)中结晶水含量的实验(图中半透膜可让气体通过又可防止固体粉末进入导管):将m1g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水,冷却至常温后,称量玻璃管中固体的质量为m2g。
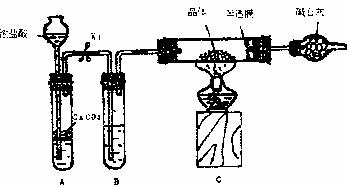
(1)B中的试剂是 。
(2)实验中有以下步骤:①打开K1 ②关闭K1 ③点燃酒精灯 ④熄灭酒精灯
火焰,使C中玻璃管冷却至常温。
正确的实验操作顺序是 (填以上选项序号)。
(3)根据实验结果,计算硫酸亚铁晶体中结晶水的n值为 。
(摩尔质量:FeSO4为152g·mol-1;H2O为18g·mol-1)
27.Ⅰ、(8分)
下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/mm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位于 。
(2)写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
②R2X2与ZX2反应:
(3)X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,
且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层满足8e-结构,且含有非极性键)的电子式 。
Ⅱ、(12分)A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应和生成物均已给出:
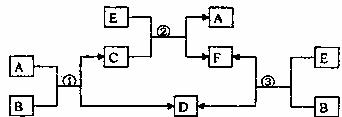
(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为 ,其中A的化学式是 。
(2)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是 。
(3)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可以实现自然界中的D和E的循环。反应①的离子方程式是 。在反应③中,若生成1molD,则转移电子数目为 。(用NA表示阿伏加德罗常数)
26.(12分)氰(CN)2的结构简式为N≡C-C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2和水反应可生成HCN和HCNO;(CN)2的氧化性比Br2弱,比I2强。
(1)下列有关反应的化学方程式不正确的是 (填选项标号)。
A.(CN)2和NaOH溶液反应:(CN)2+2NaOH NaCN+NaCNO+H2O
B.MnO2和HCN反应:MnO2+4HCN Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C.向KCN溶液中加入碘水:I2+2KCN 2KI+(CN)2
D.在NaBr和KCN混合溶液中通入少量C12:C12+2NaBr 2NaC1+Br2
(2)HCN的电子式为 。向氰化钠(NaCN)溶液中滴入酚酞试液显红色,则在等浓度、等体积的NaCN溶液与NaC1溶液中,阴离子的数目前者
(填“大于”、“小于”或“等于” )后者。
(3)处理含CN-(其中C为+2价)的工业废水常用C1O-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:
aCN-+bC1O-+2cOH- dCNO-+eN2↑+fCO32-+bC1-+cH2O
上述化学方程式可能的配平系数有多组,请回答:
①方程式中e:f的值为 。(填选项标号)。
A.1 B.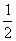 C.2 D.不能确定
C.2 D.不能确定
②若d=e=1,则b= 。
13.把Fe和Fe2O3组成的某混合物放入250mL2.0mol·L-1的HNO3溶液中,充分反应后,生成的NO气体在标淮状况下的体积为1.12L,再向反应后的溶液中加入1.0mol·L-1的NaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液的体积最少是( )
A.400mL B.450mL C.500mL D.550mL
第Ⅱ卷(非选择题)
|
本卷共10小题,共174分
12.无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成,向溶液中加入碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体,据此分析,下列判断中正确的是:①肯定有BaCl2、②肯定有MgCl2、③肯定有NaHCO3、④肯定有Na2CO3或NaHCO3、⑤肯定有Na2CO3
A.①②③ B.①③ C.②④ D.①③⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com