
26.(15分)短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;D、E两单质反应可以生成两种不同的离子化合物。
(1)B的相对分子质量最小的氢化物的结构式为 ,最高价氧化物的电子式为 。
(2)化合物甲、乙由A、B、D、E中的三种或四种元素组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为______________________________________。
(3)化合物丙、丁均由C、D两元素组成,且C、D在丙、丁中的价态相同,某温度下相互转化时的量变关系如下图所示:
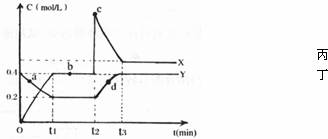
①丙的化学式是___________
②图中a、b、c、d四点中,表示反应处于平衡状态的是___________
③反应进行到t2时刻,改变的条件可能是___________
13.某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能形成化学式为NaXO3的含氧酸钠盐
C.X原子的最外层电子数和核电荷数不可能为偶数
D.X能与某些金属元素或非金属元素形成化合物
第Ⅱ卷
|
12.现有pH=5的CH3COOH溶液10 mL,要使其pH增大3,可采取的方法有 ( )
A.向溶液中加水稀释至10 L B.加入一定量的NaOH固体
C.加入一定量pH=8的NaOH溶液 D.加入NH4Cl固体
11.下列各组离子在指定条件下,一定能大量共存的是 ( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3-
B.c(H+)=0.1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D.水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
9.向100mL pH=0的硫酸和硝酸的混合液中投入3.2g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中硝酸的物质的量浓度为 ( )
A.0.2mol/L B.0.25mol/L C.0.4mol/L D.0.8mol/L
|
A.12g C60中含有60NA个电子
B.1mol HNO3见光分解,转移电子数为4NA
C.48g O2和48g O3含有的原子数分别为2NA和3NA
D.60g SiO2高温下与足量纯碱反应最多可释放出的气体分子数为NA
8.下图中,两电极上发生的电极反应如下:a极:2H+ + 2e- =H2↑,b极:Fe-2e- =Fe2+,则以下说法不正确的是( )
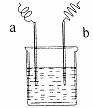
A.该装置可能是电解池
B.溶液pH变大
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
7.2008年奥运会即将在北京举行,下列有关说法中不正确的是 ( )
A.北京奥运吉祥物--福娃的材质是PVC(聚氯乙烯),其单体的结构简式为CH2=CHCl
B.北京奥运火炬--祥云火炬的燃料为丙烷,其分子式为C3H8
C.北京奥运将使用锂电池为奥运村、媒体村等处服务,这种高能电池的最显著的特点之处是提供相同的电量所需的金属正极质量最小
D.北京奥运奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2可用氧化物表示为2CaO·5MgO·8SiO2·H2O
6.下列物质中不能通过置换反应生成的是( )
A.Al2O3 B.F2 C.Fe3O4 D.C
21A.《物质结构与性质》下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有 种,属于d区的元素有 种。
(3)试比较:第一电离能I1(Cr) I1(Co)(填“>”、“<”或“=”,下同);
晶格能U(FeO) U(NaCl)(FeO与NaCl的晶胞结构相似)。
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如下图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价。
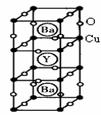
①该物质的化学式为: 。
②该物质中Cu2+与Cu3+的原子个数比为: 。
(5)现有一种含钛的晶体,其组成为TiCl3·6H2O,晶体中Ti3+的配位数为6。为测定该晶体的化学式,进行了如下实验:取一定质量的该晶体(含0.01molTi3+)配成溶液,向其中滴入足量AgNO3溶液,产生白色沉淀,沉淀完全后过滤,经洗涤干燥后称量,质量为2.87g。试推断紫色晶体的化学式为 。
21B.《实验化学》
某化学课外活动小组为了探究不同催化剂对氧化氢分解速率的影响,设计并进行了如下实验,请你完成下列各项任务。
I.氧化铜的制备。
(1)称取10g胆矾,将其放入小烧杯中,再溶于适量水配成溶液。
(2)向步骤(1)中的烧杯内滴加NaOH溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,其操作方法是 。
(4)将步骤(2)所得混合物加热至沉淀全部变为黑色。
(5)再将步骤(4)所得混合物 、洗涤、 后研细。本步骤中要验证是否洗净硫酸根离子的方法是: 。
II.比较不同催化剂对过氧化氢分解速率的影响。
该课外活动小组拟完成的实验及实验记录的表格如下,
拟采用下图所示装置来测定氧气的体积。
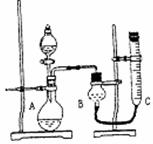
|
实验序号 |
双氧水体积 |
催化剂 |
待测数据 |
|
① |
15mL |
无 |
|
|
② |
15mL |
CuO(0.5g) |
|
|
③ |
15mL |
MnO2(0.5g) |
|
试回答下列问题:
(1)本实验中影响双氧水分解速率的因素有:①实验时的温度和压强;②双氧水的浓度;③不同的催化剂;④ ;⑤ 等。
(2)上述实验中的“待测数据”可以是 ;也可以是 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):①证明CuO的化学性质没有改变;② 。
(4)你认为可以使过氧化氢分解的催化剂还有 (填一种物质的化学式或名称)。
20.(8分)为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
回答下列问题:
(1)小组成员一致认为两个方案都可行,你认为在实验室中选择方案 更便于实施。
(2)小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是 。(填编号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(3)小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3H2O溶液,使混合溶液的PH值不断升高,当加至溶液的体积为45 mL时Al3+开始反应生成沉淀,当加至溶液的体积为50 mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)
[查阅资料]:常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,
Ksp[Cu(OH)2]=2.0×10-20mol·L-3。
请回答下列问题:
①Al(OH)3开始析出时溶液的PH应大于 。
②若溶液中离子的浓度约为1.0×10-5 mol·L-时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com