
26.(16分)
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
(1)写出下列元素的元素符号:B______________,C______________,E__________。
(2)E的最高价态与A、B、C三种元素形成酸式盐Y的化学式是_________ _____。
若Y在水溶液中完全电离成三种离子,则该盐的水溶液中所有离子浓度由大到小的顺序是_______________________________。
(3)仅由此五种元素构成的物质之间能够发生的置换反应有:__ _____、_________________________(写出两个化学方程式)。
(4)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X溶液的pH均为a,这两种溶液中由水电离出来的H+浓度分别用c(H+)1、c(H+)2表示,则
c(H+)1__________c(H+)2(填>、=或<=)。
13.向一定量的Fe、FeO和Fe2O3的混合物中加入240 mL4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出2.688L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气还原相同质量的混合物,能得到铁的物质的量为 ( )
A.0.48 mol B.0.42mol C.0.32 mol D.0.28 mol
|
12.一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是 ( )
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是 ( )
A.将容器体积变为10L,Z的平衡浓度变为原来的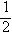
B.以Y浓度变化表示的反应速率为0.0005mol·L-1·s-1
C.若增大压强,则物质Y的转化率减小
D.若降低温度,X的体积分数增大,则该反应的△H<0
11.下列实验操作不正确的是 ( )
①向盛有20mL沸腾蒸馏水的烧杯中滴加1mL-2mLFeCl3饱和溶液。继续煮沸至溶液呈红褐色,得Fe(OH) 3胶体 ②配制FeCl3溶液时,将一定量氯化铁溶解在少量较浓的盐酸中,再用蒸馏水稀释到所需浓度 ③将氢氧化钠固体放在滤纸上称量 ④为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
A.①② B.②③ C.③④ D.①④
9.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.1mol苯分子中含碳碳双键总数为3NA
B.标准状况下,将lmolNO与0.5molO2混合后,气体的分子总数为NA
C.500mL0.5mol·L-1的Ca(ClO) 2溶液中,含有ClO-的数目为0.5NA
D.1mol甲基正离子(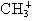 )所含电子数为8NA
)所含电子数为8NA
|
A.用50mL l2 mol·L-1盐酸与10g二氧化锰共热制取氯气
B.标准状况下,将1g铝片投入20mL l8.4mol·L-1的硫酸中
C.向100mL3 mol·L-1的硝酸中加入5.6g铁粉
D.在5×107Pa、500℃和铁触媒催化的条件下,用2mol氮气和3mol氢气合成氨
8.某溶液能完全溶解乙酸乙酯,在该溶液中可以大量共存的离子组是 ( )
A.K+、Na+、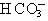 、Cl-
B.Ag+、
、Cl-
B.Ag+、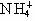 、
、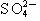 、Br-
、Br-
C.Mg2+、H+、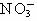 、
、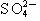 D.K+、Na+、
D.K+、Na+、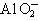 、
、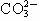
7.已知反应:①101kPa时,2H2
(g)+O2 (g)
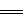 2H2O(g);△H=-484kJ·mol-1
2H2O(g);△H=-484kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) 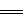 H2O(l);△H=-57.3kJ·mol-1
H2O(l);△H=-57.3kJ·mol-1
下列结论正确的是 ( )
A.氢气的燃烧热大于242kJ·mol-1
B.①的反应热为484kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.31kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
6.关于工业生产的下列叙述,正确的是 ( )
A.氯碱厂电解饱和食盐水溶液制取NaOH,为了有效地除去粗盐水中Ca2+、Mg2+、SO42-,加入试剂的合理顺序为:先加入NaOH,后加入Na2CO3,再加入BaCl2
B.在接触法制硫酸的工业生产中,SO2氧化为SO3时需要使用催化剂,这样可以提
高SO2的转化率
C.以石灰石、纯碱、石英为原料,在玻璃窑中加强热制取普通玻璃
D.合成氨生产过程中将NH3液化分离,可增大正反应速率,提高N2、H2的转化率
27.(7分)现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为 ;
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a. Na2CO3溶液 b. Ba(OH)2溶液 c. 稀盐酸。
其合理的加入顺序为 (填试剂序号);
(3)如果在容积为10L的离子交换膜电解槽中,1min后在阳极可产生11.2L(标准状况)Cl2,计算此时溶液的pH(设体积维持不变)。
26.(9分)在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=QkJ·mol-1,其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g) ΔH=QkJ·mol-1,其化学平衡常数K和温度t的关系如下:
|
t/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.25 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”);
(2)能判断该反应已达到化学平衡状态的依据是 ;
a. 容器中压强不变 b. ΔH不变
c. v正(H2)=v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时各物质的物质的量浓度(mol·L-1)的变化
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
C2 |
C3 |
C3 |
|
4 |
C1 |
C2 |
C3 |
C3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:3min时c(CO))= mol·L-1 , H2O(g)的转化率= ;
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a. 增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com