
3.以下推理正确的是
A.由甲酸可以发生银镜反应可推出其余的羧酸也均能发生银镜反应
B.NaC1与CsC1化学式相似,故NaC1与CsC1的物理性质也相似
C.由“2Fe+3C12=2FeC13”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.由H2O的沸点大于H2S的沸点可推知NH3的沸点大于PH3的沸点
2.用下图表示的一些物质或概念间的从属关系中不正确的是:

|
|
X |
Y |
Z |
|
例 |
氧化物 |
化合物 |
纯净物 |
|
A |
苯的同系物 |
芳香烃 |
芳香族化合物 |
|
B |
胶体 |
分散系 |
混合物 |
|
C |
电解质 |
离子化合物 |
化合物 |
|
D |
碱性氧化物 |
金属氧化物 |
氧化物 |
1.一定量的锎(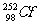 )是有用的中子源,1 mg (
)是有用的中子源,1 mg (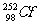 )每秒约放出2.34×199个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是
)每秒约放出2.34×199个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是
A.(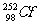 )原子中,中子数为154 B.(
)原子中,中子数为154 B.(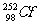 )原子中,质子数为98
)原子中,质子数为98
C.(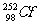 )原子中,电子数为98 D.锎元素的相对原子质量为252
)原子中,电子数为98 D.锎元素的相对原子质量为252
29.[物质结构与性质选做题] (10分).下表列出了前20号元素中的某些元素性质的有关数据:
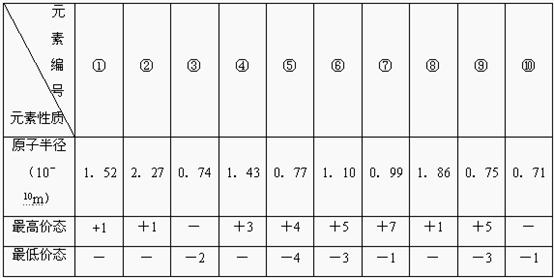
(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写编号),非金属性格最强的是 ;
(2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、 。
(3)某元素R的原子半径为1.02×10-10m,该元素是 ;其电子排布式为________________ ;
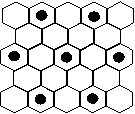
(4)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。

28.[有机化学基础选做题] (10分)已知:
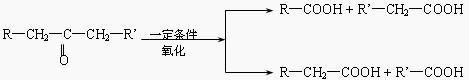
已知:A的结构简式为:CH3-CH(OH)-CH2-COOH ,现将A进行如下反应,B不能发生银镜反应, D是食醋的主要成分, F中含有甲基,并且可以使溴水褪色。


(1)写出C、E的结构简式:C_________ _、E_______ ;
(2)反应①和②的反应类型:①____________反应、②____________ 反应;
(3)写出下列化学方程式:
② F→G:_________________________________________________ ;
③ A→H:_________________________________________________ ;
27.(10分)氟化钠是一种用于农作物杀菌、杀虫剂和木材的防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
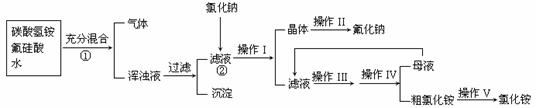
已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为2g,Na2SiF6微溶于水:
(1)流程①中H2SiF6和NH4HCO3反应得到的NH4F与H2SiO3组成浑浊液,请写出流程②中相关反应的化学方程式:② ;能够发生上述反应的原因: 。
(2)操作I和IV是相同的,请指出其名称 ;
(3)操作II中洗涤沉淀的过程是将漏斗中母液全部滤出后,
;
(4)流程①中NH4HCO3必须过量,其原因是 。
26.(10分)在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 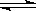 CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ; (2) 该反应的正反应为 反应(“吸热”或“放热”);
(3)能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4)在850℃时,可逆反应:CO2(g)+ H2(g)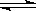 CO(g)+ H2O(g),在该容器内各物质的浓度变化如下:
CO(g)+ H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2 O ( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
25.(10分)2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。如图表示两个丙烯分子进行烯烃换位,生成两个新的烯烃分子:2-丁烯和乙烯。

现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
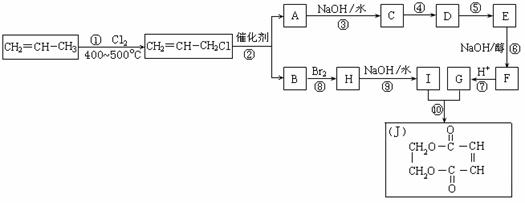
(1)反应①的类型:____________反应 ; G的结构简式:______________ ;
(2)反应②的化学方程式是___________________________________________ ;
(3)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是___________________________________,E的结构简式:_____________ ;
(4)反应⑨的化学方程式:___________________________________________ 。
24.(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O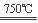 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg
 HgBr2+H2
HgBr2+H2
③HgBr2+CaO
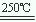 HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO
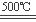 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
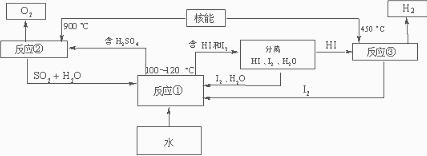
请写出反应①的化学方程式: ;
用法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
(二) [猜想II]:主要成分为氯化锌;
[验证(操作)过程]:
;
[实验现象]:
;
[判断猜想]:猜想Ⅱ成立;
由上述实验得出的结论是:滤液中的主次成分:
.
23.(10分)钼(元素符号Mo)是银灰色的难熔金属,常见化合价为+6、+5、+4,常温下钼在空气中很稳定,高于600 ℃时很快地氧化生成三氧化钼(MoO3);
辉钼精矿(主要成分为MoS2)是生产钼的主要原料。制取过程包括氧化焙烧,三氧化钼、钼粉和致密钼的制取等主要步骤,工艺流程如图:
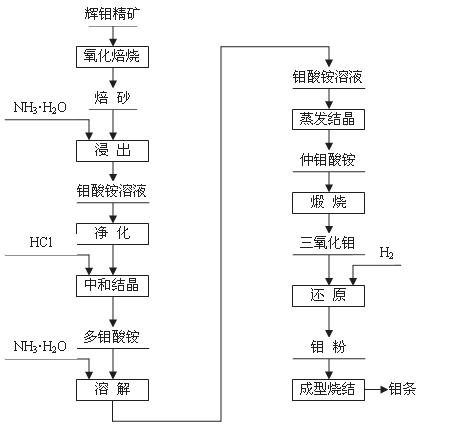
(1)辉钼精矿在600℃下进行氧化焙烧 转化为MoO3,同时产生SO2气体。主要反应的化学方程式为: 。钼冶炼厂对大气的污染主要来自于 ,你认为利用并处理该副产物的最好措施是
;
(2)三氧化钼的制取
将焙砂(主要成分:MoO3)用氨水浸出,与氨水反应生成钼酸铵[(NH4)2MoO4]溶液:反应的离子方程式为: ;
该反应: (填是或不是)氧化还原反应。
将所得钼酸铵[(NH4)2MoO4]溶液加热到55-65 ℃,用盐酸调节至溶液的pH为2,搅拌析出多钼酸铵[(NH4)2O·mMoO3·nH2O]晶体;为除去钙、镁、钠等杂质,将多钼酸铵重新溶于氨水形成钼酸铵,使氨挥发后生成仲钼酸铵晶体[(NH4)2O·7MoO3·4H2O],将仲钼酸铵晶体脱水、煅烧得纯度为99.95%的三氧化钼(MoO3)。
(3)金属钼粉的生产:
工业上在管状电炉中用氢气分两步还原三氧化钼得到钼粉:
① 在450-650℃下: MoO3 + 3H2 === MoO2 + 3H2O
② 在900-950 ℃下:MoO2 + 2H2 === Mo + 2H2O
某同学根据上述还原原理,认为还可用 等还原剂还原MoO3得到钼粉。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com