
16.(10分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2
 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2
+6H2O
MgO+H2↑ ⑤Mg3N2
+6H2O  3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
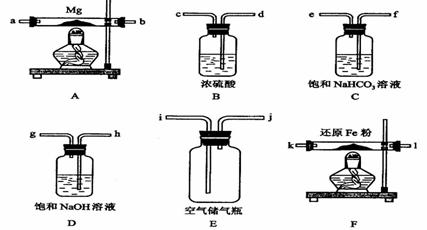
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)____________________;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是____________________;
(4)请设计一个实验,验证产物是氮化镁:
______________________________________________________________________
15.(8分)反应A(g)+B(g) C(g)
+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)
+D(g)过程中的能量变化如图所示,回答下列问题。
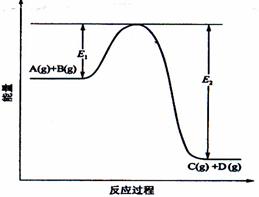
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
14.(8分)根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有_____种,金属性最强的元素与氧反应生成的化合物有_______(填两种化合物的化学式);
(2)属于稀有气体的是___________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是____________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)______________;
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
13.(8分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
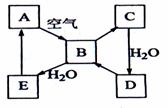
(1)写出A在加热条件下与H2反应的化学方程式
_____________________________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式___________________________
(3)写出一个由D生成B的化学方程式____________________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
12、在pH=13的无色溶液中,可以大量共存的一组离子是:
A、NH4+、NO3- 、K+、SO42- B、CO32_、NO3-、HCO3-、Na+
C、Na+、ClO-、AlO2-、NO3- D、CrO42-、K+、Na+、SO42-
第Ⅱ卷
本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第29题为选考题,考生根据要求做答。
11、下列有机反应中,不属于取代反应的是:
A.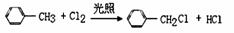
B.2CH3CH2OH+O2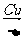 2CH3CHO+2H2O
2CH3CHO+2H2O
C、ClCH2CH=CH2+NaOH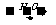 HOCH2CH=CH2+NaCl
HOCH2CH=CH2+NaCl
D、
10.X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于:
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于:
A、33% B、40% C、50% D、65%
9.下列离子方程式中,属于水解反应的是:
A、HCOOH+H2O HCOO-
+ H3O+ B、CO2+H2O
HCOO-
+ H3O+ B、CO2+H2O HCO3-
+ H+
HCO3-
+ H+
C、CO32- + H2O HCO3-
+ OH-
D、HS- + H2O
HCO3-
+ OH-
D、HS- + H2O S2-
+ H3O+
S2-
+ H3O+
8.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量
分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。
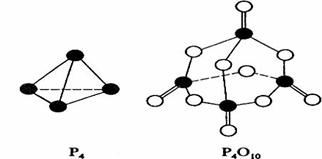
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A、(6a+5d-4c-12b)kJ·mol-1 B、(4c+12b-6a-5d)kJ·mol-1
C、(4c+12b-4a-5d)kJ·mol-1 D、(4a+5d-4c-12b)kJ·mol-1
7.关于铅蓄电池的说法正确的是:
A.在放电时,正极发生的反应是 Pb(s) +SO42-(aq)= PbSO4(s) +2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e-= Pb(s)+ SO42-(aq)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com