
16.已知常温下:Ksp[Mg(OH)2]=1.2×10-11mol3•L-3 Ksp(AgCl)=1.8×10-10mol2•L-2
Ksp(Ag2CrO4)=1.9×10-12mol3•L-3 Ksp(CH3COOAg)=2.3×10-3mol2•L-2 下列叙述正确是
A.等体积混合浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+为0.121mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
第Ⅱ卷(非选择题,共66分)
15.反应N2O4(g)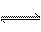 2NO2(g);△H=+57kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
2NO2(g);△H=+57kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
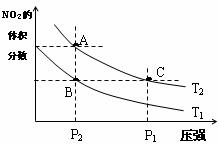
A.A、C两点的反应速率:A>C
B.A、C两点的颜色:A深,C浅
C.由状态B到状态A,可以用加热方法
D.A、C两点气体的平均相对分子质量A>C
14.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)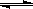 xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是 ( )
xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是 ( )
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
13. 类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中正确的是:
A.第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝
D.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
12.下列说法中错误的是
A.原子及其离子的核外电子层数等于该元素所在的周期数;
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素;
C.除氦外的稀有气体原子的最外层电子数都是8;
D.同一元素的各种同位素的物理性质、化学性质均相同
11. 根据热化学方程式S(s)+O2(g)=SO2(g)△H=一297.23kJ mol-1,下列说法中正确的是 ( )
A.S(g)+O2(g)=SO2(g)
 >297.23 kJ mol-1
>297.23 kJ mol-1
B.S(g)+O2(g)=SO2(g)
 <297.23 kJ mol-1
<297.23 kJ mol-1
C.1molSO2(g)所具有的能量大于lmolS(s)与lmolO2(g)所具有的能量之和
D.1molSO2(g)所具有的能量小于lmolS(s)与lmolO2(g)所具有的能量之和
10.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 氧-氧键的键能:498。则反应
P4(白磷)+3O2→P4O6的反应热△H为
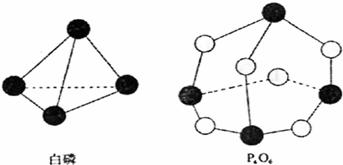
A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
9. 几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.L、R的单质与稀盐酸反应速率L<R B.M与T形成的化合物有两性
C.Q、T两元素的氢化物分子间都存在氢键 D.L、Q形成的简单离子核外电子数相等
8. 用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.12g的金刚石晶体中含有碳碳键的数目为4NA
B.1mol白磷分子所含共价键数为4NA
C.标准状况下,22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液的pH为14,又知电解后溶液总体积为1L,则阴极析出的气体的分子数为0.5NA
7. 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
下列结论正确的是 ( )
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com