
6.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
5. 下列操作中,能使水的电离平衡H2O  H+ + OH-向右移动且溶液呈碱性的是
H+ + OH-向右移动且溶液呈碱性的是
A.向水中加入NH3·H2O溶液 B.向水中加入Al2(SO4)3溶液
C.将水加热到80℃ D. 向水中加入Na2CO3溶液
4. 常温下将10mL PH=13的Ba(OH)2溶液加水稀释至100mL,所得溶液的PH为
A. 14 B. 12.7 C. 12 D. 10
3. 将0.lmol·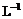 醋酸溶液加水稀释,下列说法正确的是
醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
2. 下列物质的水溶液能导电,但属于非电解质的是
A.CH3COOH B.Cl2 C.NH4NO3 D.CO2
1. 氨水中所含有的分子和离子有
①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
5.答案:(1) (2)弱于;(3)S + 2H2SO4(浓) 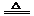 3SO2↑+
2H2O;(4)2H2O2 MnO22H2O
+ O2↑;
3SO2↑+
2H2O;(4)2H2O2 MnO22H2O
+ O2↑;
(5)NaNO2 ;(6)(3a – 4b)KJ/mol
详解:第一周期只有氢、氦两种元素,短周期元素Q、R、T、W位于元素周期表的第二、三周期,T一定在第三周期,已知T所处的周期序数与主族序数相等,T位于IIIA,最外层有3个电子,原子序数是13,T为Al,同周期相邻元素依次为硅、磷、硫,Q和硅同族,在硅元素的上一周期,Q为碳元素;R和磷同族,在磷元素的上一周期,R为氮元素,W为硫元素。
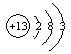
(1)T为Al,13号元素
(2)非金属最高价氧化物对应的水化物酸性越强对应的非金属性越强,S、C最高价氧化物对应的水化物分别为硫酸和碳酸,酸性:硫酸强于碳酸,则可得非金属性S强于C,即非金属性Q弱于W。
(3)S与浓H2SO4发生归中反应,0价硫和+6价硫之间只有+4价,硫元素都转化成SO2 ,氢元素、氧元素化合价不变,只能以水的形式出现,S + 2H2SO4(浓) 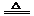 3SO2↑+
2H2O。
3SO2↑+
2H2O。
(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应:2H2O2 MnO22H2O + O2↑
(5)N中相对分子质量最小的氧化物为NO,2NO + O2 = 2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。得出热化学方程式:
C(s)
+ O2 (g) CO2
(g)
CO2
(g) 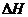 =
-a KJ/mol ①,
=
-a KJ/mol ①,
Al (s)+
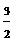 O2
(g)=
O2
(g)=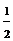 Al2O3
(s)
Al2O3
(s) 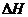 =
-bKJ/mol ②,
=
-bKJ/mol ②,
Al与CO2发生置换反应,反应方程式为:4Al(s) + 3CO2
(g)  3C(s) + 2Al2O3(s),
3C(s) + 2Al2O3(s),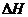 =X
=X
一个化学反应的正反应和逆反应焓变大小相等符号相反,有:CO2
(g) = C(s) + O2 (g) 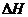 =
a KJ/mol ③
=
a KJ/mol ③
根据盖斯定律:X=4×②+3×①=(3a-4b)KJ/mol.
要点1:短周期元素是前三周期元素,是第1~3周期元素,是原子序数1~18号元素。
要点2:周期序数与主族序数相等的元素有:氢元素、铍元素、铝元素。
要点3:三类13条非金属性强弱的判断标准:
(1)理论依据:最高价氧化物对应的水化物酸性越强其非金属性越强.
①.同周期: HClO4>H2SO4>H3PO4>H4SiO4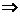 Cl>S>P>Si
;
Cl>S>P>Si
;
②.同主族:H2CO3> H4SiO4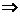 C>Si
;HNO3>H3PO4
C>Si
;HNO3>H3PO4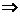 N>P
;
N>P
;
(2)位置推断:右上角元素的非金属性比左下角元素的非金属性强。
①.同周期:右>左 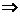 F>O>N>C>B ;Cl>S>P>Si ;
F>O>N>C>B ;Cl>S>P>Si ;
②.同主族: 上> 下 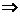 O>S ;
C>Si ;N>P ;F>Cl>Br>I
;
O>S ;
C>Si ;N>P ;F>Cl>Br>I
;
③.右上
> 左下 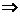 F>S>As ;N>Si ;
F>S>As ;N>Si ;
(3)实验推断:
①.与氢气反应的条件越简单,其非金属性越强。
氟气在黑暗处爆炸,氯气在光照下爆炸,溴在加热时反应,碘在持续加热的条件下反应,所以活泼性F>Cl>Br>I ;
②.与等量氢气反应时越激烈即放出的能量越多,其非金属性越强 。
③.与氢气反应的产物越稳定其非金属性越强 。
稳定性:HF>HCl>HBr>HI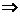 活泼性:F>Cl>Br>I ;
活泼性:F>Cl>Br>I ;
④.非金属氢化物的还原性越弱,其非金属性越强 。
还原性:HF<HCl<HBr<HI 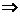 活泼性:F>Cl>Br>I ;
活泼性:F>Cl>Br>I ;
⑤.与变价金属反应,使生成物中的变价金属呈高价态的非金属性强。
2Fe+3Cl2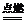 2FeCl3 ;Fe+S
2FeCl3 ;Fe+S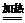 FeS ;
FeS ;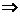 Cl2 > S ;
Cl2 > S ;
Cu + Cl2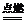 CuCl2 ;2Cu+S
CuCl2 ;2Cu+S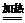 Cu2S ;
Cu2S ;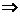 Cl2 > S ;
Cl2 > S ;
⑥.与酸发生置换反应时,反应物单质的非金属性比生成物单质的非金属性强。
Cl2+2HBr=2HCl+Br2 ; Br2+ H2S =
2HBr + S↓; 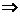 Cl2 > Br2
>S ;
Cl2 > Br2
>S ;
⑦.与盐发生置换反应时,反应物单质的非金属性比生成物单质的非金属性强。
Cl2+2NaBr=2NaCl+Br2 ;Br2+ Na2S =
2NaBr + S↓; 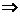 Cl2 > Br2
> S ;
Cl2 > Br2
> S ;
⑧.惰性电极电解盐溶液时,阴离子还原性越强,其对应的非金属单质的氧化性越弱,越先析出。
S2- > I- > Br- > Cl-
> OH- >F- > SO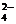 ;
; F2 >O2 > Cl2 > Br2
> I2 > S 。
F2 >O2 > Cl2 > Br2
> I2 > S 。
要点4:14个常见的归中反应归纳:
(1)氯酸钾氧化浓盐酸制备氯气:KClO3+6HCl(浓)=KCl+3Cl2 ↑+3H2O
(2)次氯酸钙氧化浓盐酸制备氯气:Ca(ClO)2 +4HCl(浓)= CaCl2+2Cl2 ↑+2H2O
(3)氯酸钾和氯化钾在盐酸酸化条件下反应产生氯气:
KClO3+5KCl+6HCl=6KCl+3Cl2 ↑+3H2O或KClO3+6HCl(浓)=KCl+3Cl2 ↑+3H2O
(4)溴酸钾和溴化钾在盐酸酸化条件下反应产生单质溴:KBrO3+5KBr+6HCl=6KCl+3Br2 +3H2O
(5)碘酸钾和碘化钾在盐酸酸化条件下反应产生单质碘:KIO3+5KI+6HCl=6KCl+3I2 +3H2O
(6)亚硫酸钾和硫化钾在盐酸酸化条件下反应产生单质硫:K2SO3+2K2S+6HCl=6KCl+3S↓ +3H2O
(7)硫代硫酸钾在盐酸酸化条件下反应产生单质硫和二氧化硫:K2S2O3+2HCl=2KCl+S↓ +SO2 ↑
(8)二氧化硫和硫化氢不能共存,发生反应:2H2S+SO2=3S+2H2O
(9)浓硫酸和非金属单质硫的反应S+2H2SO4(浓) 3SO2
↑+2H2O
3SO2
↑+2H2O
(10)浓硫酸和非金属氢化物硫化氢的反应(硫化氢的量不同产物不同)H2S+3H2SO4(浓) 4SO2
↑+4H2O
4SO2
↑+4H2O
(11)氨气消除处理汽车尾气:6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O;
(12)碳还原二氧化碳得到一氧化碳C+CO2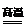 2CO
2CO
(13)铁和氯化铁溶液的反应Fe+2FeCl3=3FeCl2
(14)过量的铁和硝酸铁反应生成硝酸亚铁:Fe+2Fe(NO3)3=3Fe(NO3)2
要点5:14个常见的歧化反应
(1)在常温下氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水
Cl2+2NaOH=NaCl+NaClO+H2O;Cl2+2OH- =Cl- +ClO- +H2O
意义:实验室氯气的尾气处理方法。
(2)在加热条件下氯气和浓氢氧化钠溶液反应生成氯化钠、氯酸钠和水
3Cl2+6NaOH(浓) 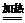 5NaCl+NaClO3+3H2O;3Cl2+6OH-
5NaCl+NaClO3+3H2O;3Cl2+6OH-
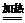 5Cl-
+ClO
5Cl-
+ClO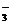 +3H2O
+3H2O
意义:结合(1)、(2)说明:同样的反应物氯气和氢氧化钠溶液,因为浓度不同、反应温度不同而产物不同,体现了不同的外界条件对化学反应的影响。
(3)氯气溶于水发生的岐化反应:Cl2+H2O=HCl+HClO;Cl2+H2O H+
+Cl- +HClO
H+
+Cl- +HClO
意义:①氯水的制备方法;②分析新制备的氯水的成分:氯分子、水分子、次氯酸分子、氢离子、氯离子、次氯酸根离子;③氯水光照,其中的次氯酸光照分解,使得上述可逆反应向正反应方向移动,最终氯水完全转化成盐酸,氯水颜色消失,漂白性消失。④在氯水中加入碳酸钙,盐酸溶解碳酸钙,氯水的平衡向正反应方向移动,次氯酸的浓度增大。⑤氯水要避光保存。
(4)双氧水催化分解得到水和氧气:2H2O2
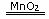 2H2O+O2↑
2H2O+O2↑
意义:①该反应是实验室制备氧气的一种方法;②在该反应中,产生1摩O2转移2摩电子;③H2O2是环保型液态氧化剂,H2O2在氧化其它物质的同时,本身被还原成水,没有其它水溶液以外的杂质产生。
(5)单质硫的歧化反应:在加热条件下硫和浓氢氧化钾溶液反应生成硫化钾、亚硫酸钾和水
3S+6KOH(浓) 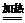 2K2S+K2SO3+3H2O;3S+6OH-
2K2S+K2SO3+3H2O;3S+6OH- 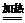 2S2-
+SO
2S2-
+SO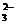 +3H2O;
+3H2O;
意义:实验室试管内残留的单质硫的化学处理方法。
(6)过氧化钠的歧化反应:过氧化钠和水反应生成氢氧化钠和氧气: 2Na2O2+2H2O=4NaOH+O2↑
意义:①过氧化钠作漂白剂,②过氧化钠和水反应后溶质的质量分数计算,③计算一定质量的过氧化钠和一定质量的水反应后溶液中钠离子和水分子的个数比。
(7)过氧化钠的歧化反应:过氧化钠和二氧化碳反应生成碳酸钠和氧气:2Na2O2+2CO2=2Na2CO3+O2
(8)过氧化钠的歧化反应:盐酸和过氧化钠反应生成氯化钠、水和氧气:2Na2O2+4HCl=4NaCl+2H2O+O2↑
(9)单质磷的歧化反应:在加热条件下磷和浓氢氧化钾溶液的反应
4P+3KOH(浓)+3H2O 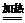 3KH2PO2+PH3↑;4P+3OH-+3H2O
3KH2PO2+PH3↑;4P+3OH-+3H2O
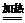 3H2PO
3H2PO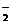 +PH3↑
+PH3↑
(10)二氧化氮的歧化反应:二氧化氮气体溶于水生成硝酸和一氧化氮气体
3NO2+H2O=2HNO3+NO;3NO2+H2O=2H+
+2 NO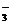 +NO
+NO
意义:工业制备硝酸的第三步反应。
(11)二氧化氮的歧化反应:二氧化氮气体溶于氢氧化钾溶液生成硝酸钾、亚硝酸钾和水
2NO2+2KOH=KNO3+KNO2+H2O;2NO2+2OH-
= NO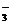 + NO
+ NO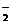 +H2O
+H2O
(12)有机酸的分解: 草酸(H2C2O4)在浓硫酸帮助下加热分解生成CO、CO2和H2O
草酸(H2C2O4)在浓硫酸帮助下加热分解生成CO、CO2和H2O
H2C2O4 CO↑+CO2 ↑+H2O
意义:①实验室制备一氧化碳的方法;②除去水蒸气和二氧化碳用碱石灰。
(13)碳族元素的单质的歧化反应:单质碳的歧化反应
过量焦炭还原二氧化硅生成碳化硅和一氧化碳气体:3C+SiO2 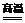 SiC+2CO↑
SiC+2CO↑
(14)副族元素的化合物的歧化反应:氧化铜的歧化反应
氧化亚铜和稀硫酸反应生成铜、硫酸铜和水:Cu2O+H2SO4=CuSO4+Cu+H2O
要点6:燃烧热概念及注意事项:
298K,1.01×105Pa时, 1摩尔物质完全燃烧生成稳定的氧化物时所放出的热量是燃烧热,可燃物中的碳元素燃烧产物为二氧化碳,可燃物中的氢元素燃烧产物为液态水,可燃物中的氮元素燃烧产物为氮气,可燃物中硫元素燃烧产物为二氧化硫。
要点7:盖斯定律:一个化学反应,不论是一步完成或是经过几个中间步骤完成,其总的热效应是相等的,盖斯定律是能量守恒定律的必然结果,也是能量守恒定律在化学过程中的应用。
例题.(08年重庆理综)化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是
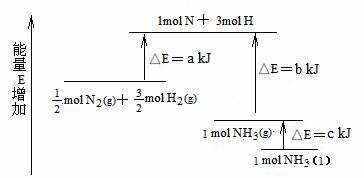
A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b-a)kJ·mol-1
C.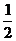 N2(g)+
N2(g)+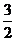 H2(g)
= NH3(l) ;⊿H = (b+c-a)kJ·mol-1
H2(g)
= NH3(l) ;⊿H = (b+c-a)kJ·mol-1
D.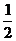 N2(g)+
N2(g)+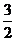 H2(g) =NH3(g)
;⊿H
= (a+b)kJ·mol-1
H2(g) =NH3(g)
;⊿H
= (a+b)kJ·mol-1
解析:根据图示信息得出如下热化学反应式:
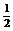 mol N2(g)+
mol N2(g)+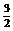 mol H2(g)
= 1mol N +3mol H ⊿E=a kJ------------------------------(1)式
mol H2(g)
= 1mol N +3mol H ⊿E=a kJ------------------------------(1)式
1mol NH3(g)= 1mol N +3mol H ⊿E= b kJ-----------------------------(2)式
1mol NH3(l)= 1mol NH3(g) ⊿E= c kJ-----------------------------(3)式
(2)式变换为:1mol N +3mol H =1mol NH3(g) ⊿E= -b kJ---------------------------(4)式
(3)式变换为:1mol NH3(g)= 1mol NH3(l) ⊿E= -c kJ---------------------------(5)式
生成1mol NH3 (l)的反应过程为:
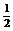 mol N2(g)+
mol N2(g)+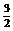 mol H2(g)
mol H2(g)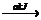 1mol N +3mol H
1mol N +3mol H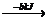 1mol
NH3(g)
1mol
NH3(g)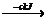 NH3(l) 。
NH3(l) 。
得出如下的热化学方程式:
N2(g)+3H2(g) = 2NH3(l); ⊿H = 2(a-b-c)kJ·mol-1 ,A选项正确。
N2(g)+3H2(g) = 2NH3(g) ; ⊿H = 2(a-b)kJ·mol-1 ,B选项错误。
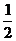 N2(g)+
N2(g)+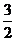 H2(g) = NH3(l) ; ⊿H =(a-b-c)kJ·mol-1 ,C选项错误。
H2(g) = NH3(l) ; ⊿H =(a-b-c)kJ·mol-1 ,C选项错误。
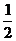 N2(g)+
N2(g)+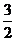 H2(g) =NH3(g) ; ⊿H = (a-b)kJ·mol-1 ,D选项错误。
H2(g) =NH3(g) ; ⊿H = (a-b)kJ·mol-1 ,D选项错误。
5.(福建理综,23,15分)

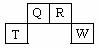
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示
,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示
,其中T所处的周期序数与主族序数相等,请回答下列问题:
 (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______.
 (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
 (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是________。
 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的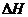 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
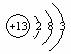
4. 答案:(1)反应物能量、生成物能量;无,降低,因为催化剂改变了反应的历程使活化能E降低。
答案:(1)反应物能量、生成物能量;无,降低,因为催化剂改变了反应的历程使活化能E降低。
(2)-198; (4) SO2 +V2O5=SO3+2VO2 ;4VO2+ O2=2V2O5 ;(4)0.025 ;0.05 。
 (5)S(s)+O2(g) =SO2(g) △H1=-296 KJ·mol-1 , SO2(g)+
(5)S(s)+O2(g) =SO2(g) △H1=-296 KJ·mol-1 , SO2(g)+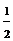 O2(g)
=SO3(g) △H2=-99
KJ·mol-1
O2(g)
=SO3(g) △H2=-99
KJ·mol-1
 3 S(s)+
3 S(s)+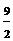 O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185
KJ·mol-1
O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185
KJ·mol-1

 [详解](1)题给已知:A→C, ΔH=-99kJ·mol-1 , A→C 是放热反应;结合图形分析,A能量比C能量高,A→C是放热反应,题给已知和图形分析吻合,所以A表示反应物能量,C表示生成物能量。反应热等于生成物的总能量减去反应物的总能量,反应热也等于反应物的键能总和减去生成物的键能总和,反应热和活化能E无关;使用催化剂可以降低活化能;
[详解](1)题给已知:A→C, ΔH=-99kJ·mol-1 , A→C 是放热反应;结合图形分析,A能量比C能量高,A→C是放热反应,题给已知和图形分析吻合,所以A表示反应物能量,C表示生成物能量。反应热等于生成物的总能量减去反应物的总能量,反应热也等于反应物的键能总和减去生成物的键能总和,反应热和活化能E无关;使用催化剂可以降低活化能;
(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 ;4VO2+ O2=2V2O5
(4)依据速率之比等于化学计量数之比;
(5)单质硫的燃烧热为296 KJ·mol-1,对应的热化学反应方程式为:S(s)+O2(g)
=SO2(g) △H1=-296
KJ·mol-1 , 1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1对应的热化学反应方程式:SO2(g)+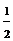 O2(g)
=SO3(g) △H2=-99
KJ·mol-1 ;根据盖斯定律,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关;1mol
S(s)→ 1mol SO3(g);对应的热化学方程式为: S(s)+
O2(g)
=SO3(g) △H2=-99
KJ·mol-1 ;根据盖斯定律,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关;1mol
S(s)→ 1mol SO3(g);对应的热化学方程式为: S(s)+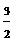 O2(g)=
SO3(g) △H3=△H1+△H2=-395
KJ·mol-1 ;
O2(g)=
SO3(g) △H3=△H1+△H2=-395
KJ·mol-1 ;
由S(s)生成3 molSO3(g)的△H4=3△H3=-11185 KJ·mol-1
[要点1]放热反应的标志:①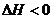 ;②根据能量和反应过程对应关系图像分析:反应物能量大于生成物能量,③拆开反应物中所有化学键所消耗的能量小于形成所有生成物中的化学键所释放能量。
;②根据能量和反应过程对应关系图像分析:反应物能量大于生成物能量,③拆开反应物中所有化学键所消耗的能量小于形成所有生成物中的化学键所释放能量。
[要点2]催化剂的7个知识点:①催化剂在反应前后质量不变、化学性质不变;②不同的催化剂改变同一化学反应的反应速率的程度不同;③催化剂的催化机理:催化剂本身先被还原,然后被氧化成催化剂本身;或者先被氧化,再被还原成催化剂本身;④催化剂是通过改变反应的活化能来改变化学反应速率的;⑤催化剂同倍数地改变正逆反应速率,不影响平衡移动;⑥催化剂使用与否和反应热无关;⑦在能量和反应过程的对应关系图像中,反应物的能量和反应体系的最高能量的差值是活化能。
[要点3]热化学方程式计量数改变反应热发生对应的变化,计量数是原来的二倍,反应热也变成原来的二倍 。
 [要点4]盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关;化学方程式叠加的同时反应热也可以同步叠加。
[要点4]盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关;化学方程式叠加的同时反应热也可以同步叠加。
4. (宁夏理综,28,14分)
(宁夏理综,28,14分) 2SO2(g)+O2(g)
=2SO3(g)反应过程的能量变化如图所示。已知1mol
SO2(g)氧化为1mol
SO3的ΔH=-99kJ·mol-1.请回答下列问题:
2SO2(g)+O2(g)
=2SO3(g)反应过程的能量变化如图所示。已知1mol
SO2(g)氧化为1mol
SO3的ΔH=-99kJ·mol-1.请回答下列问题:

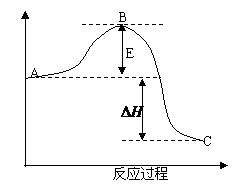
 (1)图中A、C分别表示
、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示
、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
 (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1;
 (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
;
 (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com