
4.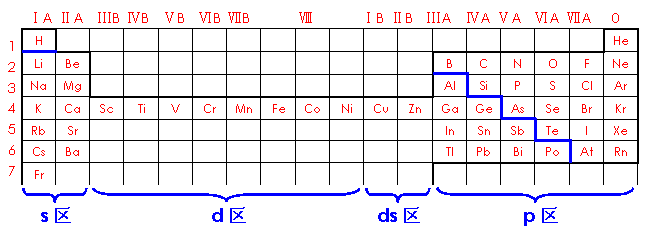 长式元素周期表的结构
长式元素周期表的结构
3.原子核外电子排布遵循的原理
|
原 理 |
内
容 |
|
能量最低原理 |
原子核外电子先占有能量低的轨道,然后依次进入能量较高的轨道,使整个原子处于能量最低状态,轨道能量高低遵循构造原理。 |
|
泡利(Pauli)(不相容)原理 |
1个原子轨道里最多只能容纳2个电子,且自旋方向相反。故原子核外没有运动状态完全相同的电子存在。 |
|
洪特(Hund)规则 |
核外电子在能量相同的各个轨道上排布时,总是尽先占据不的轨道且自旋方向相同。 |
2. 等电子数的微粒汇总
⑴“10电子”的微粒:
|
|
分子 |
离子 |
|
一核10电子的 |
Ne |
N3−、O2−、F−、Na+、Mg2+、Al3+ |
|
二核10电子的 |
HF |
OH−、 |
|
三核10电子的 |
H2O |
NH2−、H2F+ |
|
四核10电子的 |
NH3 |
H3O+ |
|
五核10电子的 |
CH4 |
NH4+ |
⑵“18电子”的微粒
|
|
分子 |
离子 |
|
一核18电子的 |
Ar |
K+、Ca2+、Cl‾、S2− |
|
二核18电子的 |
F2、HCl |
O22-、HS− |
|
三核18电子的 |
H2S |
|
|
四核18电子的 |
PH3、H2O2 、NH2F |
|
|
五核18电子的 |
SiH4、CH3F
、NH2OH |
|
|
六核18电子的 |
N2H4、CH3OH |
|
|
其它微粒 |
C2H6
、CH3NH2 |
N2H5+、N2H62+ |
1.“四种相对原子质量”的含义和关系
|
|
相对原子质量 |
近似相对原子质量 |
|
原子的 |
=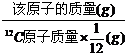 |
等于质量数 |
|
元素的 |
=Σ(同位素相对原子质量×丰度) |
=Σ(同位素质量数×丰度) |
注:元素周期表中查得的相对原子质量是指元素的相对原子质量。
24.发现中子的核反应方程是
A.2311Na+42He→2613Al+10n B.2713Al+42He→3015P+10n
 C.147N+42He →179F+10n D.94Be+42He→126C+10n
C.147N+42He →179F+10n D.94Be+42He→126C+10n
23.下列说法中,正确的是
A.核子包括质子和中子
B.原子是正负电荷均匀分布的很小的球体
C.同位素具有相同的中子数 D.同位素具有不同的质子数
22.原子的核式结构学说,是卢瑟福根据以下哪个实验或现象提出来的
A.光电效应实验 B.氢原子光谱实验 C.α粒子散射实验 D.天然放射现象
21.下列现象中,属于光的干涉现象的是
A.白光通过三棱镜形成彩色条纹 B.雨后天空出现彩虹
C.荷叶上的水珠在阳光下显得晶莹透亮 D.水面上的油膜出现彩色花纹
20.单色光不能被
A.反射 B.折射 C.漫反射 D.色散
19.利用光纤进行光纤通信所依据的原理是
A.折射 B.干涉 C.衍射 D.全反射
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com