
1.若集合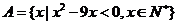 ,
,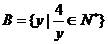 ,则
,则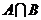 中元素个数为
中元素个数为
A.0个 B.1个 C.2个 D.3个
28.(6分)某工厂每天要烧掉含硫2.4%的烟煤200t,排放的SO2严重污染环境。如果变废为宝,把这些SO2回收利用,那么在理论上每年(以360d计算)可生产98%硫酸多少吨? 并写出有关反应的化学方程式。
绵阳南山中学2010年春季高2012级半期考试
27.(4分)已知R元素的最高价氧化物化学式为R2O3,其中氧元素的质量分数为69.0 %。R元素存在两种同位素,其中一种原子R1的核内中子数与质子数相等,另一种原子R2的核内中子数比质子数多1。
(1)R元素的相对原子质量为 (保留一位小数),R元素在周期表中的位置 。
(2)R元素的两种同位素原子数目之比N(R1)∶N(R2)= 。
26.(8分)下列A-I所代表的九种物质(或溶液中的溶质)都是你所熟悉的中学化学里常见的物质。已知A为固态单质,B为无色油状液体,常温下C、E、F都是无色气体。
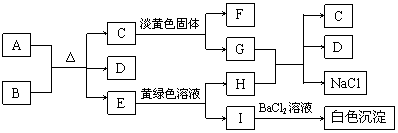
请填空:
(1)B的名称 ;有关物质的化学式:C ,D ,F ________。
(2)G与H反应的离子方程式是 ,E转变为H和I的离子方程式是 。
25.(12分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。室温下,E元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜;D元素原子核外M电子层与K电子层上的电子数相等;A可分别与B、F形成A2B,A2B2、AF等共价化合物;C可分别与B、F形成C2B、C2B2、CF等离子化合物。
请回答下列问题:
(1)E元素名称 ,AF分子的结构式 。
(2)A、 B、C、F中任选三种元素按1∶1∶1形成的化合物电子式为 (任写一例),该物质中存在的化学键有 。
(3)B、C、D、E形成的简单离子半径由大到小的顺序是 (用真实的离子符号表示)。
(4)用化学方程式表示:
①A2B与C2B2反应 ;②A2B与D单质共热 。
24.(8分)浓硫酸与铜的反应用了右图所示的装置,请回答下列问题。
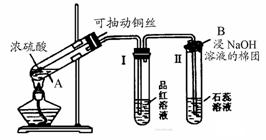 (1)Ⅰ中的现象是 ;装置Ⅱ用来证明SO2是
氧化物。
(1)Ⅰ中的现象是 ;装置Ⅱ用来证明SO2是
氧化物。
(2)写出A处反应的化学方程式 ;B处反应的离子方程式 。
(3)反应结束,待试管A内液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色。这一步操作的目的是要证实 。
(4)B中除用碱液外,还可用 等物质代替。
23.(12分)下图是元素周期表的框架,标有a- h八种元素的位置。据此回答下列问题:
|
a |
|
|
|
|
|||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
e |
|
f |
|
|
|
g |
h |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请用实线画出上面的元素周期表中金属元素与非金属元素的分界线。过渡元素位于元素周期表中第 - 纵行。
(2)写出单质的化学式:a 、h 。
(3)c元素的原子结构示意图为 ,e的离子结构示意图为 ,a和d的原子按1:1组成的化合物电子式为 ,g的最高价氧化物的化学式 。
(4)a-h八种元素,能够形成的最高价氧化物的水化物中,其碱性最强的是 ,酸性最强的是 ,具有两性的是 。
(5)用电子式表示e与g形成化合物的过程: 。
22.
X、Y、Z分别代表三种不同的短周期元素,X元素的原子最外层只有一个电子,Y元素的原子M层电子数是K层、L层电子总数的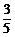 倍;Z元素的原子L层电子数只比Y原子L层电子数少2个。由这三种元素组成的化合物的化学式不可能是
倍;Z元素的原子L层电子数只比Y原子L层电子数少2个。由这三种元素组成的化合物的化学式不可能是
A. XYZ4 B. X2YZ3 C. X2YZ4 D. X2Y2Z7
第Ⅱ卷(非选择题,共50分)
21. Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A. 5 B. 4 C. 3 D. 2
20. X元素与Y元素可形成电子层结构相同的阴离子,X的氢化物水溶液呈弱酸性,向该水溶液中通入X元素的某种氧化物或Y的单质,则有X单质析出,则X和Y是
A. O和F B. S和Cl C. F和S D. S和Br
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com