
5、某合作学习小组讨论辨析以下说法:①冰和干冰既是纯净物又是化合物;②粗盐和酸雨
都是混合物;③不锈钢和目前流通的硬币都是合金;④天然气和乙醇都是可再生能源;
⑤纯碱和烧碱都是碱。上述说法正确的是 ( )
A.①②③ B.①②⑤ C.①③⑤ D.①③④
4、下图表示的实验操作正确的是 ( )
3、从分子的角度分析,下列解释错误的是 ( )
①干冰放在空气中很快就不见踪影了-------分子在不断地运动
②水变成冰,体积变大---------分子的体积变大了
③水电解后生成氧气和氢气-------分子间有间隔
④一滴水中大约有1.67×1021个水分子-------分子很小
 A.②③ B.③④ C.②④ D.全部
A.②③ B.③④ C.②④ D.全部
2、水是重要的资源。下列关于水的说法中不正确的是 ( )
A.水是由氢、氧两种元素组成的化合物
B.自来水是一种纯净物
C.氢气燃烧生成水和电解水的基本反应类型不相同
D.净化水的常用方法有吸附、沉淀、过滤和蒸馏
1、材料是人类文明进步的标志。下列不同时代物品的材料在加工、制取过程中只发生物理
变化的是 ( )




A.铁器 B.青铜器 C.高分子材料 D.石器
3、随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)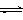 CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为_____________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
2、(2010年镇江一模)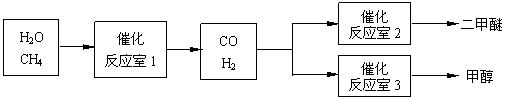 二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0。
CO(g)+3H2(g)
△H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)= 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
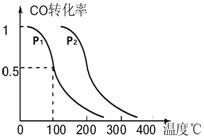 (3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO
与2amolH2,达到新平衡时,CO的转化率___ __ _
(填“增大”、“减小”或“不变”。下同。),
平衡常数 。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
[典例四](09上海高考)某反应中反应物与生成物有: 、
、 、
、 、
、 、
、 、
、 和一种未知物质X。
和一种未知物质X。
 (1)已知
(1)已知 在反应中得到电子,则该反应的还原剂是
。
在反应中得到电子,则该反应的还原剂是
。
 (2)已知0.2mol
(2)已知0.2mol 在反应中得到1mol电子生成X,则X的化学式为
。
在反应中得到1mol电子生成X,则X的化学式为
。
 (3)根据上述反应可推知
。
(3)根据上述反应可推知
。
 a.氧化性:
a.氧化性: b.氧化性:
b.氧化性:
 c.还原性:
c.还原性: d.还原性:
d.还原性:
 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
 向和数目:
向和数目:
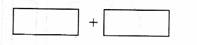
[解题步骤和方法]
[练习四]含氮废水进入水体而对环境造成的污染越来越严重,某课外兴趣小组先测定某废水中含NO为3×10-4mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关反应的离子方程式:
NO3-+Al+H2O→N2↑+Al(OH)3↓+OH-
(2)上述反应中,还原剂是________,被还原的元素是___________,每生成2molN2,将有_______mol电子发生转移。
(3)有上述废水100m3,若要完全消除污染,则所耗金属铝的质量为________kg。
[跟踪训练]
1、(2010年南通一模由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 = -72 kJ·mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ·mol-1
C(s)+CO2(g)=2CO(g)ΔH3 =+282.8kJ·mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是 。
②反应C(s)+O2(g)=CO2 (g)的ΔH = 。
2、
 (09年江苏
(09年江苏 (1)用
(1)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

 =
=


 =
=


 =
=


 在
在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化学方程式为
。
的热化学方程式为
。
 (2)控制其他条件相同,印刷电路板的金属粉末用10℅
(2)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜的平均溶解速率 (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,
其主要原因是 。
 (3)在提纯后的
(3)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。
[典例二] (08年江苏)工业上制备BaCl2的工艺流程图如下:
(08年江苏)工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) +
BaS(s) △H1 = 571.2 kJ·mol-1 ①
4CO(g) +
BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g)
+ BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g)
+ BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
[解题步骤和方法]
[练习二](2010年镇江一模)BaS溶液的制备
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
C(s)+ 1/2O2(g)=CO(g); △H = -110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s); △H = -460 kJ•mol-1

(1)煅烧还原的热化学方程式为: 。
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示) 。
[典例三](08年江苏)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
[解题步骤和方法]
[练习三]
1、(2010年无锡一模)某温度下,2SO2(g)+O2(g) 2SO3(g)
△H=-196kJ·mol-1。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ。此时二氧化硫的转化率为
,该温度下平衡常数K=
;
2SO3(g)
△H=-196kJ·mol-1。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ。此时二氧化硫的转化率为
,该温度下平衡常数K=
;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com