
2.向量 与
与 =(2,-1,2)共线,且满足
=(2,-1,2)共线,且满足 •
• =18,( k
=18,( k +
+ )⊥(k
)⊥(k –
– ),
),
则 =
,k=
.
=
,k=
.
1.已知 =(1,2,-2),若∣
=(1,2,-2),若∣ ∣=2∣
∣=2∣ ∣,且
∣,且 ∥
∥ ,则
,则 =
.
=
.
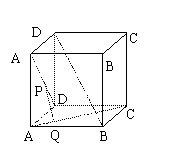 例1.在正方体ABCD–A
例1.在正方体ABCD–A B
B C
C D
D 中,P、Q分别是A
中,P、Q分别是A D与AC上的点,且PQ⊥A
D与AC上的点,且PQ⊥A D、
D、
PQ⊥AC,求证:PQ∥D B
B
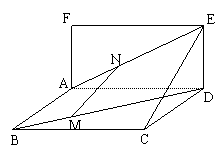 例2.如图,已知矩形
例2.如图,已知矩形 和矩形
和矩形 所在平面互相垂直,点
所在平面互相垂直,点 分别在对角线
分别在对角线 上,且
上,且 ,求证:
,求证: 平面
平面
4.已知A(1,2,3)、B(2,1,2)、P(1,1,2),点Q在直线OP上运动,则当
 •
• 取最小值时,求点Q的坐标
取最小值时,求点Q的坐标
3.已知A(2,-1,2)、B(4,5,-1)、C(-2,2,3),且 =
=
 ,则P点的坐标
,则P点的坐标
是 .
2.若 =(2x,1,3),
=(2x,1,3), =(1,-2y,9),若
=(1,-2y,9),若 、
、 为共线向量,则x=
,
为共线向量,则x=
,
y= .
1.若直线 、
、 的方向向量分别为
的方向向量分别为 、
、 ,平面α、β的法向量分别为
,平面α、β的法向量分别为 、
、 ,则
,则
⑴ ∥
∥
 ,
,
⑵ ∥α
∥α ,
,
⑶α∥β .
.
从近几年的高考试题的变迁,和对试题的分析,我们不难从中得到这样一个结论,那就是高考试题中的与社会实际、生活和现代科技的联系越来越紧密,这些题型在高考中的比重也越来越大,而这些题型的最大特征就是针对一个现实的案例或事件等,从中分析出与化学相关的信息,并用所学知识对这些现实的现象进行解释,甚至是提出相关的建议,这些都突出了对学生筛选信息、应用信息、处理信息的能力考查,提出了较高的要求。所以在复习中一定要重视这类知识的研究,当然在这里我们还要强调的是要提高知识的迁移能力和应用能力,首先要将基础知识熟练掌握,将基础知识网络化。再重视经常性地对生活实际中出现的问题、科技发展中的一些新信息进行了解和分析,这样就可增强知识的迁移能力和知识的应用能力。
考点一 元素化合物的性质
[例1]金属离子和硫离子在水溶液中的反应比较复杂,其产物与离子的水解、金属硫化物的溶解度、离子氧化性或还原性等因素有关。资料表明,CuS的溶解度很小,在稀酸溶液中也不溶解;Fe2S3的溶解度更小,但却溶于稀酸。下列有关说法正确的是
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.NH4+和S2-在水溶液中发生相互促进水解,所以不存在(NH4)2S的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物只可能是Fe2+、S
D.在酸性溶液中,S2-还原Fe3+的能力比还原Cu2+强
 变式1下列各组物质相互反应时,能产生可燃性气体的是
变式1下列各组物质相互反应时,能产生可燃性气体的是
①炭块投入热的浓硝酸中 ②铁丝投入稀硫酸中 ③过氧化钠投入水中 ④电石投入食盐水中
A.①③ B.②③④ C.①④ D.②④
考点二 元素化合物与基本概念、基本理论
[例2]下列有关比较中,大小顺序排列错误的是
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰
C.结合H+的能力:CO32->CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
[解析]根据元素周期律知识,同一周期从左到右,氢化物稳定性逐渐增强,同一主族,从上到下,氢化物的稳定性逐渐减弱,NH3中的氮原子半径小于HBr,所以N-H键能大于H-Br键能,NH3比HBr稳定,而溴的非金属性大于硫,硫大于磷,所以稳定性HBr>H2S>PH3,可知A选项错误;B选项正确,石英为原子晶体,食盐为离子晶体,冰为分子晶体,B选项正确;C选项中,酸根离子结合H+能力的强弱是看对应酸的强弱,酸性越弱对应酸根结合H+能力越强,由于硫酸是强酸,醋酸酸性强于碳酸,所以对应酸根离子结合H+能力由强到弱顺序为:CO32->CH3COO->SO42-;D选项中考查了三种分散系的粒子直径大小关系,浊液>胶体>溶液。
变式2有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1mol/L盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
考点三 生活中的元素化合物知识应用
[例3]下列有关公众安全的叙述中不正确的是
A.室内使用煤炉取暖时,为防止煤气中毒应确保煤充分燃烧和烟道通畅
B.氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域
C.家中发生天然气泄露时,应立即使用室内电话报警
D.漂白粉与浓盐酸不能混合使用,否则易产生有毒气体
[解析]煤气的主要成分为CO,为了防止煤气中毒应保证煤充分燃烧并烟道通畅;B选项中氯气泄漏时,可用蘸有肥皂水的湿毛巾捂住口鼻,原因为肥皂水呈碱性可与氯气反应而降低其毒性;C中天然气泄漏时,应立即关闭天然气开关,然后到距离泄漏处较远的地方报警,而不能用室内电话报警,因为天然气的成分为甲烷,遇火发生爆炸;D中漂白粉的成分中有次氯酸钙,能氧化盐酸成氯气,所以两者不能混合使用。
变式3下列有关生活和环境问题的一些说法,正确的是
①加碘盐中“碘”通常是碘酸钾 ②使用含磷洗涤剂后的废水不经处理直接排放,会使水体富营养化而被污染 ③我国目前正大力推广使用“无铅汽油” ④含氟牙膏的洁齿固齿效果更强 ⑤白色污染通常所指的是聚乙烯等塑料垃圾
A.全部 B.除②外 C.①③⑤ D.①②⑤
考点四 无机推断和无机框图题
[例4]已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
⑴. 若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是: 。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:_ 。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为_ _。
⑵. 若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①甲的结构式为_ _ _。
②写出上述反应的化学方程式_____ 。
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式
[解析]在无机推断中,主要是能找到题中的“题眼”,也就是一些特征反应或特征现象,或某些物质的特征颜色等。只有抓住这些特征我们才能够将各物质间的变化进行串联,进行推断出各物质的化学式以及它们间发生的反应。(1)本题的突破口为甲为三价金属氯化 变式4下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)。已知F可用作化肥,也可用来制炸药;G可用于作防腐剂或建筑工程上的抗冻剂。据此回答以下问题:
变式4下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)。已知F可用作化肥,也可用来制炸药;G可用于作防腐剂或建筑工程上的抗冻剂。据此回答以下问题:
 [
[
(1)单质A必定是______(填“金属”或“非金属”),理由是_____________。
(2)写出反应①的化学方程式_____________。并指出该反应在现代化学工业上的实际意义_________。
(3)物质B的分子空间构型为___________________________。
(4)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为______。
(5)写出反应③的离子方程式______________________________________________。
无机推断是近年来高考中无机的最难题,也是近几年的必考题,在解决无机框图题的关键是找到图中的“题眼”,而一般“题眼”总是隐藏于各物质间的相互转化或某转化中产物的特征现象,或是某物质的特征状态、特征颜色、特征的性质中等。所以在复习中要总结化学中常见物质的特征反应、常见物质的特征颜色、常见物质的特征用途或制备等。
如常见物质的颜色:①有色气体单质:F2、Cl2、O3;②其他有色单质:Br2(深棕红色液体)、I2(紫黑色固体)、S(淡黄色固体)、Cu(紫红色固体)、Au(金黄色固体)、P(白磷是白色蜡状固体,红磷是暗红色粉状固体)、Si(灰黑色晶体)、C(黑色粉未);③无色气体单质:N2、O2、H2;④有色气体化合物:NO2 (红棕色);⑤常见固体的颜色:黄色固体:S(淡黄色)、FeS2(淡黄色)、 Na2O2(淡黄色)、AgBr(淡黄色)、Ag3PO4(黄色)、AgI(黄色);黑色固体:FeS、FeO、Fe3O4(黑色晶体)、MnO2、C、CuS、PbS、CuO;红色固体:Fe(OH)3(红褐色)、Fe2O3(红棕色)、Cu2O、Cu;蓝色固体:五水合硫酸铜(胆矾或蓝矾);绿色固体:七水合硫酸亚铁(绿矾);紫黑色固体:KMnO4、碘单质;白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3;有色离子(溶液):Cu2+、Fe2+、Fe3+、MnO4-、Fe(SCN)2+;不溶于稀酸的白色沉淀:AgCl、BaSO4;不溶于稀酸的黄色沉淀:S(淡黄色)、AgBr(淡黄色)、AgI等。
每种元素及其化合物之间的相互转化,各族间元素及化合物间的转化等无不是在基本理论和基本概念的指导下从知识点发展到知识链,如通过依托元素周期律和元素周期表可以将一种元素的结构和性质与它的同族元素进行比较和辨析,同时也能将该元素在横向中与同周期的元素及其化合物进行比较和辨析,通过这样的复习方式,不仅能很好地掌握该元素的性质等,同时还能从横向和纵向联系其它元素,也就巩固了其它元素及化合物的性质,同时也能将各独立的元素及化合物的知识块转化成知识网,更有利于知识的迁移和应用;再如将元素及化合物放在氧化还原反应的理论下进行复习,这样不仅能巩固氧化还原反应理论,同时还能进一步巩固元素化合物的知识,同时还可将各种元素或化合物在氧化和还原的过程中进一步形成元素间的联系及想到间的转化,也就更利于将各元素化合物进行综合和联结成网,这样更有利于元素化合物知识的迁移和应用。如:
金 属 单 质 还 原 性 逐 渐 减 弱
 K、Ca2+、Na、Mg、Al、Zn、Fe、Sn、Pb、(H、)、Cu、Hg、Ag、Pt、Au
K、Ca2+、Na、Mg、Al、Zn、Fe、Sn、Pb、(H、)、Cu、Hg、Ag、Pt、Au
K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+……(H+、)Cu2+、Hg2+、Ag+……
 金 属 离 子 氧 化 性 逐 渐增 强
金 属 离 子 氧 化 性 逐 渐增 强
 非金属单质氧化性逐渐减弱
非金属单质氧化性逐渐减弱
F2、Cl2、O2、Br2、I2、S
F-、OH-、Cl-、Br-、I-、S2-
 阴离子氧化性逐渐增强
阴离子氧化性逐渐增强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com