
5.下列各组加点字,字义相同的两项是
A.东郭先生将北适以干仕 B.哭声直上干云霄
C.不从车乘,不操干戈 D.亦不敢服垢弊以干名
[答案]A、D(都是动词,求取之意。B项"干",冲犯,D项读gàn,才干)
4.下列各组加点字,字义相同的两项是
A.直前诟虏师失信 B.自可断来信,徐徐更谓之
C.信臣精卒陈利兵而谁何 D.俄匀谢玄淮上信至
E.信造化之尤物也
[答案]B、D(这两个"信"都是名词,都是指送信的人。C项"信臣",忠臣;E项 "信"副词,确实)
3. 下列各组加点的字解释错误的一项是
A.天理云集响应,赢粮而景从:同"影"
B.屈平既绌,其后秦欲伐齐:同"黜",被罢免
C.北救赵而西却秦,此五霸之伐也:讨伐,征伐
D.京师学者咸怪其无征:验应
[答案]C(伐,功业)
2.下列各组加点的字解释错误的一项是
A.惟辟作福,惟辟作威:君主
B.举孝廉不行,连辟公府不就:开辟也 :同"避",躲避
C.其北陵,文王之所辟风雨也:同"避",躲避
D.唇吻翕辟,不知何词:张开
[答案]B(辟,征召)
1.下列各组加点的字解释错误的一项是
A.沛公不胜杯杓:禁住,能承受 B.上下同欲者胜:取得胜利
C.何可胜道也者:尽 D.数石之重,中人不胜:获胜
[答案]D(胜,能承受,“中人”,普通人)
3.铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。 “速力菲”是市场上一种常见的补铁药物,下表格是它的说明书。
|
[规格]
每片含琥珀酸亚铁0.1g [适应症] 用于缺铁性贫血症,预防及治疗用。 [用量用法] 成人预防量0.1g/日,成人治疗量0.2g-0.4g/日, 小儿用量预防量30-60mg/日,治疗量0.1g-0.3g/日。 [儲藏] 避光、密封、在干燥处保存 |
(1) 该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用。
① 为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 ___________ ( 填试剂的名称 )
② 实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应)。请配平下列离子方程式
______MnO4- + ______Fe2+ + ______H+ == ______Mn2+ + ______Fe3+ + ______H2O
③ 称量上述含铁元素质量分数为20.00% 的“速力菲”10.00 g,将其全部溶于稀硫酸中,配制成1000.00 mL溶液,取出20.00 mL,用0.01 mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00 mL。该药品可以服用吗?__________ ____(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)_______ 。
(2) 已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸。含23.6 g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式) ,
琥珀酸亚铁的化学式为 。
[参考答案]
(1) ①硫氰化钾溶液
② _1__MnO4- + __5__Fe2+ + __8__H+ == __1___Mn2+ + __5__Fe3+ + _4_H2O
③不可以 n(Fe2+) = 0.01 mol/L×12.00×10-3L ×5×(1000.00 mL/20.00 mL) = 0.03 mol
m(Fe2+)=0.03 mol×56 g/mol=1.68 g
(10 g×20.00% - 1.68 g)/(10 g×20.00%) = 16.00% ﹥ 10% ,所以不可以服用。
(2)HOOC-CH2-CH2-COOH + 2NaOH → NaOOC-CH2-CH2-COONa +2H2O
FeC4H4O4
2、铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
 ⑴ 试剂1是
,试剂2是
,加入新制氯水后溶液中发生的离子反应方程式是
,
;
⑴ 试剂1是
,试剂2是
,加入新制氯水后溶液中发生的离子反应方程式是
,
;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
[参考答案]
⑴ 稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl- Fe3++SCN-=[Fe(SCN)]2
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色 4Fe(OH)2+2H2O+O2=4Fe(OH)3
⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
1.莽草酸是合成抗禽流感药物“达菲”的重要中间体,其分子式为C7H10O5。莽草酸能使溴的四氯化碳溶液褪色,等质量的莽草酸与足量的金属钠或NaHCO3反应时产生的气体体积不等。以下是以莽草酸为原料的一种合成路线(部分反应条件已省略)。
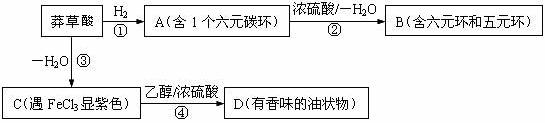
请回答下列问题:
(1)写出莽草酸分子中含有的官能团名称:羧基、 、 。
(2)指出反应类型:① ,③ 。
(3)下列对莽草酸说法正确的是 。
A.所有碳原子在同一平面上
B.莽草酸可以发生加成、消去、酯化反应
C.莽草酸可以与氯化铁溶液发生显色反应
D.1 mol莽草酸与足量钠反应可以产生4 mol H2
E.莽草酸分子中含有3个手性碳原子
(4)A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。已知有机物分子中含有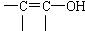 或
或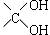 的结构不能稳定存在。写出化学方程式:
的结构不能稳定存在。写出化学方程式:
反应②
反应④
[参考答案]
(1)羟基 碳碳双键(2)①加成 ③消去(3)BE(4)反应②:
|
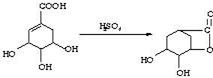 + H2O
+ H2O
|
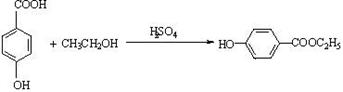 +H2O
+H2O4、对关键学生注意加强纠错训练。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com