
3.探究方案:
⑴ 在试管中加入约五分之一体积的水,用铁架台固定(试管口向上倾斜约45°,管口对着没有人的方向),点燃酒精灯加热。如图1-1所示。加热一段时间后,可见水沸腾,在试管口有“白气”发出。用冷而干燥的玻璃片贴近“白气”,一会儿后,玻璃片上有水滴出现。说明在此变化过程中,水由液态受热变成气态的水蒸气,而后遇冷凝结成液态水,水本身没有发生变化,没有新物质生成。
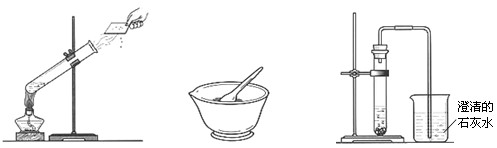
图1-1 图1-2 图1-3
⑵ 取少量胆矾,放在研钵内,用研杵研碎(注意是“研”,即通过研杵对药品的挤压而使其粉碎,不可用磨杵“捣”,以免损坏研钵),观察到蓝色颗粒状胆矾变成了浅蓝色粉末状胆矾。没有新物质生成。如图1-2所示。
⑶ 在试管里分别加入少量研碎的胆矾粉末,并加入少量水,振荡,直至硫酸铜全部溶解为止。观察硫酸铜溶液的颜色为蓝色。将溶液平均分装到两支试管中,一支留做比照,另一支中用滴管滴加数滴氢氧化钠溶液。观察到试管内有蓝色絮状沉淀物出现。说明该变化过程中,有新物质生成。
⑷ 取少量块状石灰石放入干燥的试管里,向其中加入少量稀盐酸,用配有玻璃弯管的橡皮塞塞住试管口,使弯管的另一端伸入盛有澄清石灰水的烧杯里。如图1-3所示。观察到石灰石表面出现大量气泡,澄清石灰水变浑浊,证明石灰石与稀盐酸作用,生成了二氧化碳。该变化中有新物质生成。
2.实验仪器:试管、铁架台、酒精灯、玻璃片、研钵、烧杯等。
实验药品:水、胆矾、氢氧化钠溶液、石灰石、澄清石灰水等。
1.原理:
⑴ 通过水的蒸发和冷凝,说明物质状态的变化过程中,没有生成新的物质。是物理变化。
⑵ 通过对胆矾的研磨,颗粒状固体胆矾变成粉末状胆矾,说明物质的形状发生改变时,不生成新的物质。是物理变化。
⑶ 硫酸铜溶液与氢氧化钠溶液反应,生成硫酸钠和氢氧化铜,说明反应过程中生成了新的物质,是化学变化。
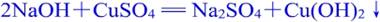
⑷ 石灰石(主要成分是碳酸钙)与稀盐酸反应,生成二氧化碳,将气体通过澄清石灰水[主要成分是氢氧化钙] ,出现浑浊。证明变化过程中产生了新的物质,是化学变化。
6. 创新思维
①可以用干燥管或者漏斗来连接在导管前,以便增大白磷与氧气的接触面积,使水中白磷的燃烧现象更加明显。
②将燃烧匙中的红磷点燃后插入盛有二氧化碳的集气瓶,白磷熄灭,熄灭的原因是没有跟氧气接触,将燃烧匙从盛有二氧化碳的集气瓶中拿出,迅速插入盛有氧气的集气瓶,红磷又开始燃烧了,因为红磷的温度仍然在着火点以上,又跟氧气接触了。
5. 资源开发
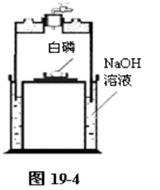
①用“沉浮式贮气瓶”制取大量氮气的方法。
取一套气罩容积为2000mL的“沉浮式贮气瓶”,向容器里加入500 mL 10%浓度的氢氧化钠溶液,在容器中心的圆柱平台上放一片薄木板,木板上放一只金属的瓶盖(起隔热作用,防止白磷燃烧时烫坏贮气瓶的容器)。取花生米大小的一块白磷,用滤纸吸干表面的水分,放入瓶盖里。用烧热的玻璃棒接触白磷,白磷燃烧起来后,立即把“沉浮式贮气瓶”的气罩插入容器,静置大约3-4分钟后,气罩里的氧气被白磷耗尽,至少得到1500 mL的氮气。如图19-4所示。
②双连球的替代。
许多实验室没有双连球,可用塑料洗瓶来代替双连球。在洗瓶盖的喷嘴上套上橡皮管,橡皮管的另一端连接玻璃导管,并用弹簧夹夹紧橡皮管。用排水法收集一洗瓶氧气,拧紧瓶盖备用。用洗瓶替代双连球更加简便、实用。
4. 探究评价
方案①装置简单,但实验效果没有方案②明显,方案②可以反复实验,能加深学生的感性认识,更能说明燃烧的条件。
3. 探究方案
方案⑴:在250 mL的烧杯中放入一小块白磷,并注入200 mL的热水。在烧杯上盖一片薄铜片,铜片一端放一小块已用滤纸吸去表面水分的白磷,另一端放一小堆干燥的红磷。如图19-1。过一会,铜片上的白磷因满足燃烧的条件而燃烧,热水中的白磷因没有跟氧气接触而不能燃烧,铜片上的红磷因没有达到着火点而不能燃烧(白磷的着火点约40℃,红磷的着火点约240℃)。说明燃烧需要同时满足三个条件:①物质具有可燃性;②温度达到可燃物的着火点;③可燃物跟氧气接触。如果用双连球向水中白磷周围通入氧气,白磷在热水中也能燃烧。如图19-2。如果将铜片上的红磷放在酒精灯上加热,使红磷的温度继续升高,红磷就可以燃烧了。

方案⑵:用沉浮式贮气瓶和木炭来探究燃烧的条件。如图19-3。
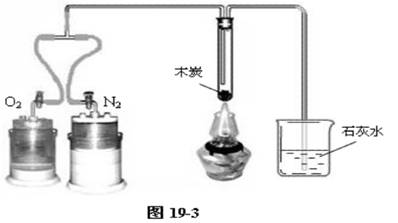
不给试管中的木炭加热。通氧气,不燃烧,石灰水无变化--木炭温度未达到着火点;通氮气,不燃烧,石灰水无变化--木炭温度未达到着火点,木炭未与氧气接触。
给试管中的木炭加强热。通氮气,不燃烧,石灰水无变化--木炭温度虽已达到着火点,但是木炭未与氧气接触;通氧气,剧烈燃烧,石灰水变混浊--木炭温度已达到着火点,木炭与氧气接触,满足燃烧的条件;再通氮气,燃烧立即熄灭--木炭温度虽已达到着火点,但是木炭未与氧气接触。
2. 实验仪器:烧杯、导管、铜片、双连球、贮气瓶、塑料洗瓶等
实验药品:白磷、红磷、木炭等
1. 化学反应原理
①磷在空气中燃烧: ; ②木炭在氧气中燃烧:
; ②木炭在氧气中燃烧:
6.创新思维:
⑴ 利用缓慢氧气测定氧气的体积分数
如图5-6所示,取长10cm,宽1.5cm的铝箔,用细线系好。在其表面涂一层硝酸汞的药液,立即用滤纸将铝箔擦干,迅速放入粗玻璃管中,悬于玻璃管上部,立即插入盛水的小烧杯中,塞上塞子,静置观察。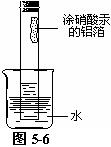
① 铝跟空气中的氧气反应放出的热,使玻璃管壁变得温热;
② 玻璃管内水位慢慢上升,10min左右,水位上升停止。进入的水的体积约为玻璃管未浸入水中部分容积的1/5。
进行该实验时,应当注意:
硝酸汞溶液的浓度要大。铝箔表面涂硝酸汞溶液后要立即用滤纸擦干后再放入试管中,否则,铝跟硝酸汞反应置换出来的汞,在形成铝汞齐的条件下,铝会跟水反应产生氢气,使测定出的氧气体积分数偏低。
⑶ 利用蜡烛燃烧测定氧气的体积分数
蜡烛燃烧产生二氧化碳气体,常温下二氧化碳仅微溶于水,且溶解速度比较慢,因此一般不用蜡烛燃烧测定氧气的体积分数。但若能吸收二氧化碳,此法也不失为一种简便的方法。而且蜡烛易燃烧,取材方便,可鼓励学生在家自己动手实验。
如图5-7所示,在水槽中盛适量的稀氢氧化钠溶液,并滴入2-3滴酚酞试液,在小木片上固定一只短蜡烛(普通蜡烛1cm,生日蜡烛2-3cm),用火柴点燃蜡烛。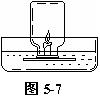
把集气瓶倒扣在小木块上方,并将瓶口水封。几秒钟后,蜡烛火焰熄灭,水位上升。且进入瓶中的液体变红色。
在水下用玻片盖上集气瓶,取出,量得集气瓶中水的体积,约为集气瓶容积的1/5。
若学生在家做此实验,可用茶杯代替集气瓶,用石灰水代替稀氢氧化钠溶液(若无石灰水,用清水效果也很好)。
该实验简便、粗略,可多次重复,容易被学生接受。缺点是,在盖上集气瓶开始时,由于气体膨胀,有气泡从瓶口冒出,导致实验测得的值偏大。
⑶用加热氧化法测空气成分
把长约2cm的一束细铜丝装进一根长约5-6cm的普通玻璃管中部,两端用两节橡皮管分别跟两只注射器(其中一只注射器留出50mL空气,另一只注射器不留空气)连接起来,使之成为一个密闭系统(如图5-8)。推动注射器活塞,空气可以通过装铜丝的玻璃管在两只注射器间来回传送,不会泄漏。
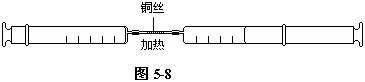
给装有细铜丝的玻璃管加热,待铜丝的温度升高以后,缓缓地交替推动两只注射器的活塞,使空气在铜丝上来回流动。经过5-6次以后,空气里的氧气可以全部与铜结合。
停止加热,冷至室温,读出残留的注射器里气体的体积数。减少的体积即为50mL空气中所含氧气的体积。由此可以推算出空气中氧气的体积分数。
做该实验时,要注意注射器不宜太小,太小体积变化不大,现象不明显。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com