
5]在一个不传热的固定容积的密闭容器中,可逆反应N2(气)

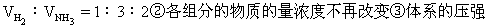
不再发生变化④混合气体的密度不变(相同状况)⑤体系的温度不再发
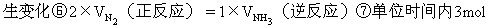
H-H断键反应同时2molN-H也断键反应
A.①②③⑤⑥ B.②③④⑤⑥
C.②③⑤⑥ D.②③④⑥⑦
[答案] B
[解析]达到化学平衡状态的标志是平衡理论里一个重要的基本概念,当外界条件一定时,若正反应速率等于逆反应速率,反应混合 物中各物质的百分组成不变,化学反应达到平衡状态。我们不仅要了解概念的定义,而且还应了解其表现的多样性和其实质。误选A的原因是将化学反应速率和化学平衡中的正、逆反应速率混为一谈。教材中给反应速率下了如下定义:通常用单位时间内反应物的浓度减小或生成物的浓度增大来表示,这仅表示是正反应速率。另由化学反应中各物质的变化量与反应方程式的系数成比例,推导出:在化学反应中各物质的反应速率与方程式的系数成正比,即①所示,也只能表示正反应速率,而不能表示正、逆反应速率之间的关系。⑥说明:N2减少的速率和NH3(作为逆反应的反应物)减少的速率与方程式的系数成正比,如单位时间内1mol·L-1的氮气参加反应,生成2mol·L-1的氨,同时2mol·L-1的氨气也参加反应生成1mol·L-1的氮气,正、逆反应速率相等,应为平衡的标志。
物中各物质的百分组成不变,化学反应达到平衡状态。我们不仅要了解概念的定义,而且还应了解其表现的多样性和其实质。误选A的原因是将化学反应速率和化学平衡中的正、逆反应速率混为一谈。教材中给反应速率下了如下定义:通常用单位时间内反应物的浓度减小或生成物的浓度增大来表示,这仅表示是正反应速率。另由化学反应中各物质的变化量与反应方程式的系数成比例,推导出:在化学反应中各物质的反应速率与方程式的系数成正比,即①所示,也只能表示正反应速率,而不能表示正、逆反应速率之间的关系。⑥说明:N2减少的速率和NH3(作为逆反应的反应物)减少的速率与方程式的系数成正比,如单位时间内1mol·L-1的氮气参加反应,生成2mol·L-1的氨,同时2mol·L-1的氨气也参加反应生成1mol·L-1的氮气,正、逆反应速率相等,应为平衡的标志。
误选D的原因是疏忽大意较多,忽略了每mol氨分子含有3molN-H键,单位时间内3molH-H断键反应同时6molN-H也断键反应才能表示正、逆反应速率相等。
 误选C是
误选C是 认为④不是达到平衡的标志,其原因是思维定势和综合应用能力较弱。物质的密度等于其质量除以体积,对于固体或液体来说,由于其体积随温度或压强变化不大,因此一般不考虑随状态的变化。但气体体积是状态的函数,随状态变化而由较大的变化,如果不是在相同状态下比较密度,就失去其意义。该反应是气体
认为④不是达到平衡的标志,其原因是思维定势和综合应用能力较弱。物质的密度等于其质量除以体积,对于固体或液体来说,由于其体积随温度或压强变化不大,因此一般不考虑随状态的变化。但气体体积是状态的函数,随状态变化而由较大的变化,如果不是在相同状态下比较密度,就失去其意义。该反应是气体 总体积减少的放热反应,反应又在一个不传热的固定容积的密闭容器中进行,混合气体的密度变化一定存在,换算较为复杂。是否可从混合气体的平均摩尔质量入手,而气体的密度之比又等于其摩尔质量之比,问题就变为简单。本反应的气体总质量不变(反应物和生成物皆为气体),混合气体的物质的量减小,平均摩尔质量增大,密度增大,密度不变应视为达到平衡的标志。
总体积减少的放热反应,反应又在一个不传热的固定容积的密闭容器中进行,混合气体的密度变化一定存在,换算较为复杂。是否可从混合气体的平均摩尔质量入手,而气体的密度之比又等于其摩尔质量之比,问题就变为简单。本反应的气体总质量不变(反应物和生成物皆为气体),混合气体的物质的量减小,平均摩尔质量增大,密度增大,密度不变应视为达到平衡的标志。
[状元纠错]总之对达到化学平衡状态的标志描述是多方面的:从微观上分析,单位时间内形成化学键的键数,得失电子数……等都可以表示反应速率;从宏观上分析,各物质的浓度,体系内物质的颜色,体系的压强,体系的温度,混合气体的平均摩尔质量……等都可以反映出各物质的百分组成变化。在表示反应速率时,一定是表示正反应速率和逆反应速率相等。在讨论百分组成变化时,要注意观察方向,如气体的颜色;适用的范围,如从压强、混合气体的平均摩尔质量上判断,仅适用于反应前后气体的物质的量不等的反应。
4] 3molA和2.5molB混合于2L密闭容器中,发生如下反应:
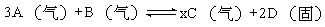
5分钟后,反应达到平衡,测得C的平均速率为0.1mol·L-1·min-1并生成1molD。求①VA,VD;②x;③αB;④[C]平


由D的变化量根据各物质的变化量和方程式系数成正比解出:x=2;B的变化量为0.5mol,进而解出B的转化率为20%;C在平衡时,其物质的量为1mol,其浓度为0.5mol·L-1。
[状元纠错]①VA=0.15mol·L-1·min-1;VD=0.1mol·L-1·min-1
3]下列关于四个图像的说法正确的是 ( )

A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H大于0
B.图②为氢氧燃料电池示意图,正、负极通入气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
 D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
[错误分析]错选B或D,氢氧燃料电池总反应为2H2+O2=2H2O,由方程式可知道氢氧体积比就为2:1所以选B;错选D,依据“先拐先平”的原理,乙的压强大比甲的大。错选B忽略了正负极的问题,在正极放电是氧气,在负极放电是氢气,正、负极通入气体体积之比为1:2;错选D忽略了物质的状态,反应前后压强并不相等。
[答案]C。
[状元纠错]A中表示为放热反应,△H小于0,B中氢氧燃料电池总反应为2H2+O2=2H2O,由方程式可知道氢氧体积比就为2:1,C中b随温度变化溶解度变化不大,而a溶解度变化很大,所以可以用结晶方法从a、b混合物中提纯a;D中不能表示压强对平衡的影响,因为压强不同,平衡时各组分的百分含量也不同,而图示为压强不同平衡时各组分的百分含量相同。
2]一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);DH<0。现将1
mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是(
)
2C(g)+D(g);DH<0。现将1
mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是(
)

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲
中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积
分数是甲中C 的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反
应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省 略)
略)
[错误分析]错选A或C,错选A因为在甲中再加入1 mol A和2 mol B与开始加入的和在一起与乙中物质的量相当,但体积只有乙的一半,所以认为A正确;错选C因为甲的量相当于乙中量的一半,当体积相等时就有B正确。错选A,B都是因为忽略在改变条件时,该平衡发生了移动,因此必须在新的条件下考虑各组分量的关系。
[答案]BD。
[状元纠错]做好此题关键是分析清楚,条件改变,平衡如何移动。A中可以建立假设的思维模型,设甲的体积与乙的相等,按两次投料后建立平衡,此时与乙等效,再将甲的体积缩小为原来的一半,平衡会向逆向移动,C的量就会小于乙中C的浓度的2倍,B中升高温度,平衡逆向移动,B的体积增加,而气体总体积却减少,甲、乙中B的体积分数均增大;C中相当于压缩乙,增大压强,平衡向逆向移动,乙中C的体积分数小于甲中C 的体积分数的2倍;D中由于K不动,增加氦气不影响平衡移动,而乙由于增加了气体的量,活塞右移,体积增大,压强减小,所以平衡发生向正向移动。故D正确。
1]一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
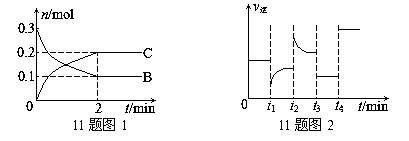
下列有关说法正确的是( )
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
[错误分析]错选A或C,错选A,当 x=2时,v(B)=(0.3-0.1)/2=0.1
mol/(L·min);错选C,若增大 c(C),反应将向逆反应方向移动,B的物质的量增大,所以B的物质的量分数增大。错选A是没有看清楚图,纵轴表示物质的物质的量,而反应速率的公式中分子是浓度的变化;错选C是模糊了物质的量和物质的量分数之间的关系,物质的量增加并不意味着物质的量分数增加。
c(C),反应将向逆反应方向移动,B的物质的量增大,所以B的物质的量分数增大。错选A是没有看清楚图,纵轴表示物质的物质的量,而反应速率的公式中分子是浓度的变化;错选C是模糊了物质的量和物质的量分数之间的关系,物质的量增加并不意味着物质的量分数增加。
[答案]D。
[状元纠错]本题主要涉及化学平衡图象的识别和判断,图1是浓度-时间图,图2为速率-时间图,A中,当 x=2时,v(B)=(0.3-0.1)/2/2=0.05 mol/(L·min),B中此反应△H<0,降温平衡正向移动。C中结合图2逆反应速率增大,平衡逆向移动,B的物质量增大,但是总的物质的量也在增大,所以无法确定B的物质的量分数不一定增大。D项中改变压强,平衡不移动,使用催化剂,平衡亦不移动。
4.已知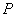 是△
是△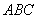 内任一点,且满足
内任一点,且满足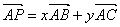 (
(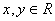 ),则
),则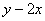 的取值范围是
.
的取值范围是
.
3.某中学高三年级共有学生1200人,一次数学考试的成绩(试卷满分150分)服从正态分布N(100,δ2),统计结果显示学生考试成绩在80分到100分之间的人数约占总人数的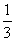 ,则此次考试成绩不低于120分的学生约有
人;
,则此次考试成绩不低于120分的学生约有
人;
2.巳知椭圆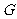 的中心在坐标原点,长轴在
的中心在坐标原点,长轴在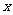 轴上,离心率为
轴上,离心率为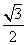 ,且
,且 上一点到
上一点到 的两个焦点的距离之和为12,则椭圆
的两个焦点的距离之和为12,则椭圆 的方程为
.
的方程为
.
1.(江西省十所重点中学2010届一联14)设点O在△ABC的外部,且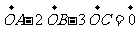 ,则
,则 =
;
=
;
(二)选考题:共45分。请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题号必须与所涂题目的题号一致,在答题卡区域指定位置大题。如果多做,则每学科按所做的第一题计分。
33.[物理-选修3-3](15分)
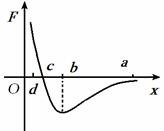 (1)(5分)如图所示,甲分子固定在坐标原点O,乙分子位于x轴上,甲分子对乙分子的作用力与两分子间距离的关系如图中曲线所示,F﹥0为斥力,F﹤0为引力,a、b、c、d为x轴上四个特定的位置,其中C点为曲线与x轴的交点。现把乙分子从a处由静止释放,则
(1)(5分)如图所示,甲分子固定在坐标原点O,乙分子位于x轴上,甲分子对乙分子的作用力与两分子间距离的关系如图中曲线所示,F﹥0为斥力,F﹤0为引力,a、b、c、d为x轴上四个特定的位置,其中C点为曲线与x轴的交点。现把乙分子从a处由静止释放,则
A.乙分子由a到b做加速运动,由b到c做减速运动
B.乙分子由a到c做加速运动,到达c时速度最大
C.乙分子由a到b的过程中,两分子间的分子势能一直减少
D.乙分子由b到d的过程中,两分子间的分子势能一直增加
(2)(10分)一气象探测气球,在充有压强为1.00atm(即76.0cmHg)、温度为27.0℃的氦气时,体积为3.50m3。在上升至海拔6.50km高空的过程中,气球内氦气逐渐减小到此高度上的大气压36.0cmHg,气球内部因启动一持续加热过程而维持其温度不变。此后停止加热,保持高度不变。已知在这一海拔高度气温为-48.0℃。求:
①氦气在停止加热前的体积。
②氦气在停止加热较长一段时间后的体积。
34.[物理-选修3-4](15分)
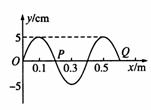 (1)(5分)如图所示是一列简谐横波在t=0时的波形图,若波的传播速度为2m/s,P点向上振动,则下列说法中正确的是( )
(1)(5分)如图所示是一列简谐横波在t=0时的波形图,若波的传播速度为2m/s,P点向上振动,则下列说法中正确的是( )
A.波向右传播
B.再经过△t=0.4s质点P向右移动0.8m
C.再经过△t=0.4s质点P仍在平衡位置,它通过的路程为0.2m
 D.再经过任意时间质点Q和P的振动情况总是相同的
D.再经过任意时间质点Q和P的振动情况总是相同的
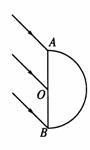
(2)(10分)如图所示,AOB为半圆形玻璃砖截面,玻璃的折射率为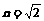 ,现有一束平行光线以45°角入射到AB面上后,经折射从半圆面上的部分位置射出。试求半圆柱面能被照亮的部分与整个半圆柱面的面积之比。
,现有一束平行光线以45°角入射到AB面上后,经折射从半圆面上的部分位置射出。试求半圆柱面能被照亮的部分与整个半圆柱面的面积之比。
35. [物理-选修3-5](15分)
[物理-选修3-5](15分)
(1)(5分)如图所示为氢原子的能级图。用大量能量为12.75eV的光子照射
一群处于基态的氢原子,氢原子发射出不同波长的光波,其中最多包含有几种
不同波长的光波
A.3种 B.4种
C.5种 D.6种

(2)(10分)在光滑水平面上有一个静止的质量为M的木块,一颗质量为m的子弹以初速度v0水平射入木块而没有穿出,子弹射入木块的最大深度为d。设子弹射入木块的过程中木块运动的位移为s,子弹所受阻力恒定。试证明:s < d。
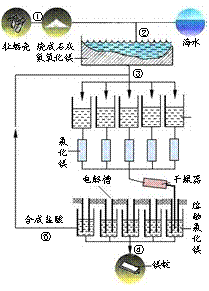
36.[化学--选修化学与技术] (15分)
工业生产镁的流程如右图所示。
(1)在生产中属于分解反应的是 (填标号)
(2)在生产中有一种物质可以循环利用,它是 (填名称)
(3)用盐酸溶解Mg(OH)2时会引入Fe3+,可用 除去。
A. NaOH B.NH3×H2O C. MgO
D. Mg(OH)2 E. MgCO3
除去Fe3+的离子方程式为
(任写一个)
(4)将MgCl2×6H2O转变为电解用MgCl2要在HCl气流中加热,
原因是 。
(5)电解法制取镁的阳极电极反应式为 。
37.[化学--选修物质结构与性质](15分)
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是 。
C60和金刚石都是碳的同素异形体,金刚石熔点高于C60的熔点,原因是
。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的原子结构示意图: 。
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般的为d0或d10排布时,无颜色;为d1-d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+
颜色(填“无”或“有”)。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2的电子式为 。
②写出基态Fe外围电子排布图 。
③Fe的下列性质中,不能用“电子气”理论加以解释的是
A.易导电 B.易导热 C.有延展性 D.易腐蚀
38.[化学--选修有机化学基础](15分)
咖啡酸苯乙酯(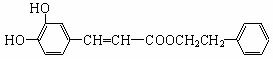 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化:
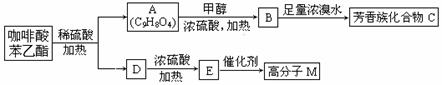
请填写下列空白。
(1)D分子中的官能团是 。
(2)高分子M的结构简式是 。
(3)写出A → B反应的化学方程式: 。
(4)B → C发生的反应类型有 。
(5)A的同分异构体很多种,其中,同时符合下列条件的同分异构体有 种。
①苯环上只有两个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应。
39.[生物-选修1生物技术实践](15分)
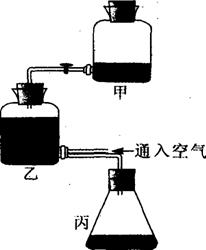 生物技术在食品加工中的应用十分广泛,如果酒、果醋、腐乳、泡菜就是生活中常见的例子。如图是果酒制果醋的发酵装置,分析回答:
生物技术在食品加工中的应用十分广泛,如果酒、果醋、腐乳、泡菜就是生活中常见的例子。如图是果酒制果醋的发酵装置,分析回答:
(1)如果将该装置改为酒精的发酵装置,则温度应该控制 在 。果酒制果醋的反应式为: 。缺少糖原时,醋酸菌将 变为 ,再变为醋酸。
(2)果汁发酵后是否有酒精产生,可以用 来 检验,在 条件下,该物质与酒精反应呈现 色。
(3)请指出用该发酵装置的一个缺点 。
40.[生物-选修3现代生物科技专题](15分)
生态工程就是遵循自然界物质循环的规律,充分发挥资源的生产潜力,防止环境污染,达到经济效益和生态效益的同步发展。
(1)生态工程所遵循的基本原理是 、
、 、
、 。
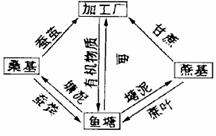 (2)右图某地区的农民结合生态工程原理建立了特有的蔗基鱼塘和桑基鱼塘。请根据此图回答:
(2)右图某地区的农民结合生态工程原理建立了特有的蔗基鱼塘和桑基鱼塘。请根据此图回答:
① 这种人工生态系统最基本的生物因素是_____
_____ 和________ _;要使它长期稳定发展,
除了有稳定的能量,各类生物还要______________
________。
②蚕粪、蔗叶进入鱼塘经过____________的作用
又被桑和蔗所利用。蚕粪中的氨经过________的
作用,形成____________________被植物吸收。
③建立这一生态系统的目的是________________________________ ___。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com