
2、硫的氢化物
①硫化氢的制取:
Fe+H2SO4(稀)=FeSO4+H2S↑(不能用浓H2SO4或硝酸,因为H2S具有强还原性)
--H2S是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质
 A.可燃性:当
A.可燃性:当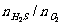 ≥2/1时,2H2S+O2
点燃 2S+2H2O(H2S过量)
≥2/1时,2H2S+O2
点燃 2S+2H2O(H2S过量)
 当
当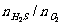 ≤2/3时,2H2S+3O2
点燃 2SO2+2H2O(O2过量)
≤2/3时,2H2S+3O2
点燃 2SO2+2H2O(O2过量)
当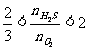 时,两种反应物全部反应完,而产物既有硫又有SO2
时,两种反应物全部反应完,而产物既有硫又有SO2
B.强还原性:常见氧化剂Cl2、Br2、Fe3+、HNO3、KMnO4等,甚至SO2均可将H2S氧化。
C.不稳定性:300℃以上易受热分解
③H2S的水溶液叫氢硫酸,是二元弱酸。
例1:室温时,H2S和O2的混合气体100mL,点燃后充分反应,剩余25mL,求H2S
和O2的体积比。
解析:剩余的25mL气体可能是什么?①H2S ②O2和SO2 ③SO2
①若H2S过量,余25mL H2S
则参加反应的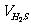 =75mL×
=75mL×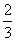 =50mL
=50mL
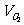 =75mL×
=75mL×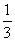 =25mL
=25mL
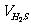 :
: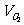 =(50+25):25=3:1
=(50+25):25=3:1
②若为O2和SO2 则O2过量,据:2H2S+3O2 = 2SO2+2H2O △V
2 3 2 3
2LH2S完全反应,体积减少3L,现减少100mL-25mL=75mL
则需H2S的体积为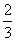 ×75mL=50mL,O2的体积为75mL,75mL+50mL>100mL,不可能。
×75mL=50mL,O2的体积为75mL,75mL+50mL>100mL,不可能。
③两种反应物完全反应,产物为S、SO2和H2O
设H2S的体积为aO2的体积为b
则aH2S+bO2=(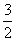 a-b)S+(b-
a-b)S+(b-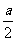 )SO2+aH2O
)SO2+aH2O
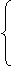 a+b=100
a+b=100
 a=50mL
b=50mL
a=50mL
b=50mL  体积比为1:1。
体积比为1:1。
b-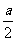 =25
=25
1、硫
(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态)
2Na+S===Na2S (剧烈反应并发生爆炸)
 2Al+3S △ Al2S3(制取Al2S3的唯一途径)
2Al+3S △ Al2S3(制取Al2S3的唯一途径)
 Fe+S △ FeS(黑色)
Fe+S △ FeS(黑色)
 2Cu + S △ Cu2S(黑色)
2Cu + S △ Cu2S(黑色)
②与非金属反应
 S+O2 点燃 SO2
S+O2 点燃 SO2
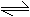 S+H2 △ H2S(说明硫化氢不稳定)
S+H2 △ H2S(说明硫化氢不稳定)
③与化合物的反应
 S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
 S+2H2SO4(浓) △ 2SO2↑+2H2O
S+2H2SO4(浓) △ 2SO2↑+2H2O
 3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
19、用图3-5所示的实验过程,测定含Na2SO3的亚硫酸钠中Na2SO3的质量分数(Na:23克/摩;Ba:137克/摩;S:32克/摩).
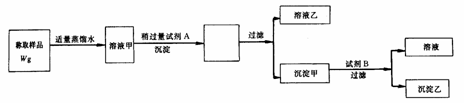
图3-5
测定沉淀乙(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是 ,检验A稍过量的方法是 ;
(2)试剂B溶液是 ,B的作用是 ;
(3)沉淀甲的化学式是 ,沉淀 乙的化学式是 ;
(4)沉淀甲与B反应的离子方程式是 ;
18. 下图是有关硫及其化合物的实验装置:
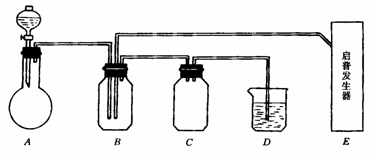
实验中用到的实验试剂在下列中选择:①浓硫酸;②70%硫酸;③25%硫酸;④新开封的亚硫酸钠粉末;⑤硫化亚铁;⑥氢氧化钠溶液;⑦溴水;⑧碳酸钠溶液.
在实验开始不久即在B瓶中析出固体粉末状物质.试回答:
(1)A中分液漏斗盛放的试剂是 平底烧瓶中盛有的试剂是 .其中在实验时反应的化学方程式为 .
(2)B中的化学方程式是 ,反应的氧化产物和还原产物的物质的量比是 .
(3)E(启普发生器)中盛有的两种试剂及发生反应的离子方程式是:试剂 ,反应: .
(4)如果A、E两装置气体发生速度相同,流量也相同时,在D中反应的离子方程式是
.
(5)D的作用是 ,C的作用是 .
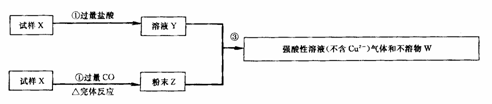
17.试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按图3-3所示进行实验:
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶液物W的质量是M,则
每份试样X中氧化铜的质量为 (用m表示)
D.奥赛一瞥
16.①向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式
.
②在以中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式
.
15.向50毫升,18摩/升H2SO4溶液中加入足量铜片并加热.充分反应后,被还原的H2SO4
的物质的量( )
A.小于0.45摩 B.等于0.45摩
C.在0.45摩和0.90摩之间 D.大于0.90摩
C.能力训练
14.使用浓H2SO4时,若不慎沾在皮肤上,正确的清洗方法是( )
A. 用饱和的NaOH溶液中和
B. 用大量水冲洗,然后用3%-5%碳酸氢钠溶液清洗,并涂上碳酸氢钠溶液
C. 用干布擦,然后用水冲洗
D.用稀氨水冲洗
13.等物质的量的氯气和二氧化硫气体通入滴有紫色石蕊试液的氯化钡溶液中,以下叙述正确的是( )
A.无沉淀产生,溶液变成无色 B.产生BaSO3沉淀,溶液变成红色
C.产生BaSO4白色沉淀,溶液变色成红色 D.产生BaSO3白色沉淀,溶液变成无色
12.下列说法正确的是( )
A. 能使石灰水变浑浊的气体一定是CO2
B. 能使品红溶液褪色,将其煮沸又变红的无色气体一定为SO2
C. 用NaHSO3,Na2SO3与浓H2SO4反应都可产生SO2
D.某酸性溶液经分析含大量S2-,SO42-,MnO4-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com