
18.某温度下硫酸铜的溶解度是25g,若温度不变,将32g无水硫酸铜粉末放入mg水中,形成饱和溶液并有胆矾晶体析出时,则m的取值范围是( )
A.18g≤m≤128g B.36g<m<180g C.18g<m<128g D.36g≤m≤128g
[解析]假设32g无水硫酸铜粉末与mg水刚好形成饱和溶液,则有: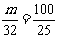 ,m=128g;再假设32g无水硫酸铜粉末与mg水刚好形成胆矾晶体,则有:
,m=128g;再假设32g无水硫酸铜粉末与mg水刚好形成胆矾晶体,则有: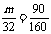 ,m=18g;鉴于饱和溶液和胆矾晶体并存,故有18g<m<128g。
,m=18g;鉴于饱和溶液和胆矾晶体并存,故有18g<m<128g。
[答案]C
17.(2008·江西9校联考)物质X2SO4的饱和溶液的密度为ρg·mL-1 ,c(x+)= n mol·L -1 ,溶质质量分数为α%, 溶质的式量为M ,溶解度为S ,下列表达式正确的是( )
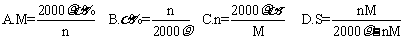
[解析]根据题意,利用基本关系式分别计算即可。
溶质质量分数:α% =(S/100+S)×100% …… ①
溶质的物质的量浓度:c(x+)= n =10ρα/ M …… ②
联立①②可得溶解度:S = 100nM /(1000ρ- nM)
[答案]A
15.(2008·山东聊城)一定温度和压强下,乙腈(CH3CN)是极易溶于水的无色液体,这时向质量分数为a的乙腈水溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a。若同样条件下乙腈的密度为d1,水的密度为d2,则下列说法正确的是( )
A.d1<d2 B.d1>d2 C.d1=d2 D.无法确定
[解析]由“向质量分数为a的乙腈水溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a”可知乙腈的密度小于水的密度。
[答案]A
能力提高训练
14.(2008·汕头市五校联考)已知t℃时,某物质的不饱和溶液a g中含有溶质m g。若将该溶液蒸发b g水并恢复到t℃时,析出溶质m1 g ;若将原溶液蒸发c g水并恢复到t℃时,则析出溶质m2 g。S表示该物质在t℃时的溶解度,则下列正确的是( )
A.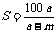 B.
B.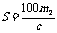 C.
C.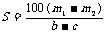 D.
D.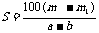
[解析]由题意知,(c-b)g水和(m2-m1)g溶质刚好可形成饱和溶液。故有:
(c-b)/(m2-m1) = 100/s 解得:s = 100(m2-m1)/(c-b)
[答案]C
13.(2008·攀枝花)甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
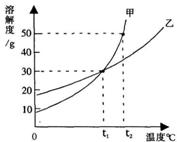 A.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全溶解
A.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全溶解
B.t1℃时,甲和乙的饱和溶液中溶质的质量分数相等
C.t2℃时,在l00g水中放入60g甲,所得溶液溶质的质量分数为37.5%
D.t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
[解析]由溶解度曲线图可知,t1℃时,甲、乙的溶解度都为30g,也即100g水中可溶解30g溶质,所得的溶液的溶质的质量分数相等,故A不正确,B正确;t2℃时,甲的溶解度为50g,在l00g水中放入60g甲,所得溶液过饱和,溶液溶质的质量分数为33.3%,故C不正确;因乙的溶解度随温度的变化较小,所以降低温度,乙先达到饱和,故D不正确。
[答案]B
12.(2008·湛江模拟)已知某盐在不同温度下的溶解度如下表.若把质量分数为22%的该盐溶液,由50℃逐渐冷却,则开始析出晶体的温度范围是( )
|
温度℃ |
0 |
10 |
20 |
30 |
40 |
|
溶解度(g/100g水) |
11.5 |
15.1 |
19.4 |
24.4 |
37.6 |
A.0℃-10℃ B.10℃-20℃ C.20℃-30℃ D.30℃-40℃
[解析]由表中数据易知,30℃时饱和溶液的质量分数为:24.4/124.4 =19.6%;40℃时饱和溶液的质量分数为:37.6/137.6 =28.1%
[答案]D
11.(2008·杭州一模)下列关于胶体和溶液的叙述正确的是( )
A.溶液呈电中性,胶体带电荷
B.溶液中溶质微粒一定不带电,胶体中分解质微粒带有电荷
C.通电后溶液中溶质微粒分别向两极移动,胶体中分散质微粒向某一极移动
D.胶体是一种稳定的分散系
[解析]胶体和溶液一样是电中性的,只是胶体粒子带电荷,故A不正确;溶液中溶质的微粒有的带电、有的不带电,电解质溶液中的溶质微粒就有带电的,非电解质溶液中溶质的微粒就不带电。胶体中的分解质微粒也有不带电的,如淀粉胶体,故B不正确;由于电解质溶液中溶质微粒可能不带电,因此通电时也不一定向两极移动,故C不正确。
[答案]D
10.(2008·泰州市模拟)下图是A.B两种物质的溶解度曲线,根据图示回答下列问题:
(1)t1℃时,向两只盛有100g水的烧杯中,分别加入A.B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是___________溶液(填“A”或“B””)。
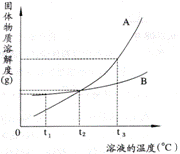 (2)t2℃时,欲配制等质量的A.B两种物质的饱和溶液,所需水的质量关系是A_ ___B。 (填写“>”、“<”或“=”,下同)
(2)t2℃时,欲配制等质量的A.B两种物质的饱和溶液,所需水的质量关系是A_ ___B。 (填写“>”、“<”或“=”,下同)
(3)将t2℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A______B。
(4)将t2℃的A、B两种物质的饱和溶液各200g,升温至t1℃,欲使它们仍为饱和溶液,若不改变溶剂质量,所需加入固体溶质的质量关系是A_______B。
[答案](1)B (2) = (3) > (4) >
基础提升训练
9.(2005·广东)下列有关溶液性质的叙述,正确的是( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水可溶解34.2g KCl,此时KCl 饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
[解析]气体的溶解度随着温度的降低而增大,故A不正确;B中KCl 饱和溶液的质量分数为:34.2/134.2=25.5﹪,故B不正确;电解质的强弱与其溶解性无关,故C不正确。
[答案]D
8.(2008·黄冈中学)Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )
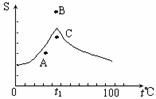 A.A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4·H2O晶体都可使其饱和
A.A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4·H2O晶体都可使其饱和
B.B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度
C.在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊。
D.制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体。
[解析]由Na2SO4溶液的溶解度曲线可知,A、B、C三点中A、C为不饱和状态,B为过饱和状态。
[答案]BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com